
| A. | H2、D2、T2互为同素异形体 | |
| B. | 液氨、氨水、王水都是混合物 | |
| C. | H2O、苯酚、Fe(SCN)3都是弱电解质 | |
| D. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
分析 A、同种元素形成的不同单质互为同素异形体;
B、液氨是液态氨气,属于纯净物;
C、弱电解质是指在水中不完全电离,只有部分电离的化合物,主要包括弱酸、弱碱、少部分盐和水;
D、纯碱是碳酸钠的俗称.
解答 解:A、H2、D2、T2 都是氢元素组成的,结构相同,属于同一物质,故A错误;
B、液氨是液态氨气,属于纯净物,氨水是氨气水溶液、王水是浓盐酸与浓硝酸的混合物,故B错误;
C、水是弱电解质;苯酚、Fe(SCN)3在水中部分电离,属于弱电解质,故C正确;
D、纯碱是碳酸钠的俗称,叫碱不是碱,属于盐类,故D错误;
故选C.
点评 本题考查了物质的分类,注意物质组成的理解应用,掌握概念实质是关键,题目较简单.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol12C原子的质量是12g,1个12C原子的质量是$\frac{12}{{N}_{A}}$g | |
| B. | 在常温常压下,11.2L N2含有分子数为0.5NA | |
| C. | 18 g水所含有的氢原子数目为2NA,氧原子数目为NA | |
| D. | 1L 0.1mol•L-1 Na2SO4溶液中,Na+和SO${\;}_{4}^{2-}$的离子总数是0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
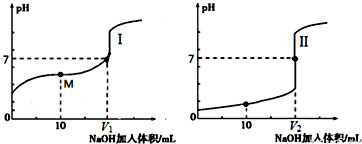
| 操作步骤 | 现象 |
| 步骤1:向20mL0.05mol/LAgNO3溶液中加入20mL0.05mol/LKSCN溶液,充分反应后过滤 | 出现白色沉淀 |
| 步骤2:向滤液中加少量2mol/LFe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2所得溶液中,加入少量3mol/LAgNO3溶液 | 现象a |
| 步骤4:取步骤1所得少量滤渣加入到适量的3mol/LKI溶液中 | 出现黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
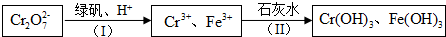
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
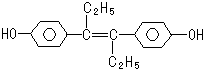
| A. | 它易溶于有机溶剂 | |
| B. | 该有机物可与少量Na2CO3反应放出CO2气体 | |
| C. | 1mol该有机物可以与5mol Br2发生反应 | |
| D. | 该有机物分子中,可能有16个碳原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com