
【题目】X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是元素周期表中原子半径最小的元素;Y元素基态原子有三个能级上有电子,且每个能级上的电子数相等;Z元素基态原子的单电子数在同周期元素基态原子中最多;W与Z同周期,第一电离能比Z的低;R与Y同主族;Q的最外层只有一个电子,其他电子层均有2n2个电子(n表示电子层序数)。请回答下列问题:
(1)Q的核外电子排布式为___。
(2)化合物X2W2中W的杂化方式为___;ZW2-的空间构型为___。
(3)Y、R的最高价氧化物中沸点较高的是___(填化学式),原因是___。
(4)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图所示,该晶体的晶胞中所含Y原子的个数为___,Y原子的配位数为___,若晶胞的边长为apm,晶体的密度为ρg/cm3,则阿伏加德罗常数的值NA为___(用含a和ρ的代数式表示)。
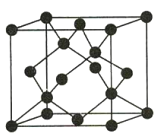
【答案】1s22s22p63s23p63d10(或[Ar]3d10) sp3杂化 V形 SiO2 SiO2为原子晶体,CO2为分子晶体 8 4 ![]()
【解析】
X是元素周期表中原子半径最小的元素,则X为H元素;Y有三个能级上有电子,且每个能级上的电子数相等,则Y的核外电子排布式为1s22s22p2,故Y为C元素;R与Y同主族,结合原子序数大小顺序可知,R为Si元素;而Z元素基态原子的单电子数在同周期元素基态原子中最多,则Z的价电子排布式为ns2np3,且原子序数小于Si,则Z为N元素;W与Z同周期,第一电离能比Z的低则W为0元素;Q的最外层只有一个电子,其他电子层均有2n2个电子,不可能为短周期元素,原子序数小于30,故核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,则Q为Cu元素,以此分析。
根据以上分析可知X、Y、Z、W、R、Q分别是H、C、N、O、Si、Cu。
(1)Cu+的核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10,
故答案为:1s22s22p63s23p63d10(或[Ar]3d10);
(2)化合物H2O2的结构式为H—0—0—H,O原子价电子对数为4,故0原子采取sp3杂化;![]() 中N原子的孤电子对数为
中N原子的孤电子对数为![]() ,价电子对数为2+1=3,故其空间构型为V形,
,价电子对数为2+1=3,故其空间构型为V形,
故答案为:sp3杂化;V形;
(3)Y、R的最高价氧化物分别为CO2、SiO2,SiO2为原子晶体,CO2为分子晶体,故沸点较高的是SiO2,
故答案为:SiO2;SiO2为原子晶体,CO2为分子晶体;
(4)题图晶胞中所含C原子的个数为![]() ;每个C与周围的4个C原子相邻,故C原子的配位数为4;若晶胞的边长为apm,则晶胞的体积为(a×10-10)3cm3,晶体的密度为
;每个C与周围的4个C原子相邻,故C原子的配位数为4;若晶胞的边长为apm,则晶胞的体积为(a×10-10)3cm3,晶体的密度为![]() ,则晶胞的质量为
,则晶胞的质量为![]() ,则
,则![]() ,故
,故![]() ,
,
故答案为:8;4;![]() 。
。


科目:高中化学 来源: 题型:
【题目】温度为T0时,X(g)和Y(g)在2 L的密闭容器中发生反应生成Z(g),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述中错误的是
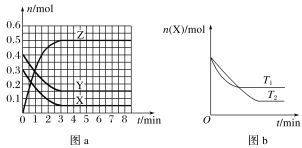
A.反应的方程式为X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.X(g)与Y(g)生成Z(g)的反应是放热反应
C.图a中反应达到平衡时,Y的转化率为62.5%
D.T1时,若该反应的平衡常数K的值为50,则T1>T0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷晶体的晶胞结构如图所示,下列说法正确的是( )

A.甲烷晶胞中的球只代表1个C原子
B.晶体中1个CH4分子周围有12个紧邻的CH4分子
C.甲烷晶体熔化时需克服共价键
D.1个CH4晶胞中含有8个CH4分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物材料衍生物2,5-呋喃二甲酸(![]() )可以替代化石燃料衍生物对苯二甲酸,与乙二醇合成材料聚2,5-呋喃二甲酸乙二醇酯(PEF)。下列说法正确的是
)可以替代化石燃料衍生物对苯二甲酸,与乙二醇合成材料聚2,5-呋喃二甲酸乙二醇酯(PEF)。下列说法正确的是
A. 合成PEF的反应为加聚反应
B. PEF不能与氢气发生加成反应
C. 通过红外光谱法测定PEF的平均相对分子质量,可得其聚合度
D. 聚对苯二甲酸乙二醇酯的结构简式为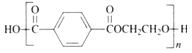
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示。下列关于该有机物的说法正确的是( )
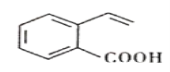
A.该有机物能发生酯化、加成、氧化、水解等反应
B.该有机物中所有碳原子不可能处于同一平面上
C.与该有机物具有相同官能团的同分异构体有3种
D.1mol该有机物最多与4molH2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (CH3)2CHCH2OH是某物质X的还原产物,则X不可能是( )
A.乙醛的同系物B.丁醛的同分异构体C.CH2=C(CH3)CH2OHD.乙醇的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用碳和水蒸气制备水煤气的核心反应为:C(s)+H2O(g)H2(g)+CO(g)
(1)已知碳(石墨)、H2、CO的燃烧热分别为393.5kJ·mol-1、285.8kJ·mol-1、283kJ·mol-1,又知H2O(l)=H2O(g) ΔH=+44kJ·mol-1,则C(s)+H2O(g)CO(g)+H2(g) ΔH=___。
(2)在某温度下,在体积为1L的恒容密闭刚性容器中加入足量活性炭,并充入1mol H2O(g)发生上述反应,反应时间与容器内气体总压强的数据如表:
时间/min | 0 | 10 | 20 | 30 | 40 |
总压强/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
①平衡时,容器中气体总物质的量为________mol,H2O的转化率为________。
②该温度下反应的平衡分压常数Kp=________kPa(结果保留2位有效数字)。
(3)保持25℃、体积恒定的1L容器中投入足量活性炭和相关气体,发生可逆反应C+H2O(g)CO+H2并已建立平衡,在40 min时再充入一定量H2,50min时再次达到平衡,反应过程中各物质的浓度随时间变化如图所示:
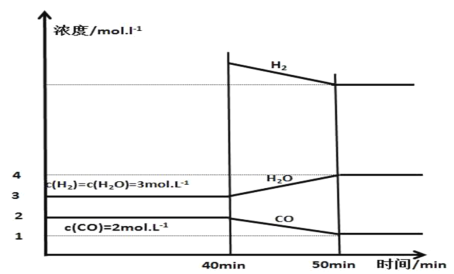
①40min时,再充入的H2的物质的量为________mol。
②40~50 min内H2的平均反应速率为________mol·L-1·min-1。
(4)新型的钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:
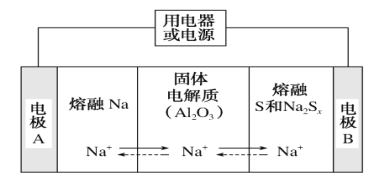
①放电时,电极A为________极,S发生________反应(填“氧化”或“还原”)。
②充电时,总反应为Na2Sx=2Na+Sx(3<x<5),Na所在电极与直流电源________极相连,阳极的电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
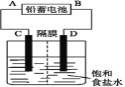
已知:铅蓄电池在放电时发生下列电极反应:
负极Pb+SO42--2e- =PbSO4
正极PbO2+4H++SO42-+2e- =PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式_________________________。
(2)若在电解池C极一侧滴酚酞溶液,电解一段时间后未呈红色,说明铅蓄电池的A极为____极。
(3)用铅蓄电池电解1 L饱和食盐水(食盐水足量、密度为1.15 g/cm-3)时,
①若收集到11.2 L(标准状况下)氯气,则至少转移电子________ mol。
②铅蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为__________L。
③消耗硫酸a mol,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气全部排出)__________________________________(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,是某种有机物分子的球棍模型图。图中的“棍”代表单键或双键,不同大小的“球”代表三种不同的短周期元素的原子。对该有机物的叙述不正确的是
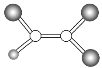
A.该有机物可能的分子式为C2HCl3
B.该有机物的分子中一定有碳碳双键
C.该有机物分子中的所有原子在同一平面上
D.该有机物分子中形成的化学键都是极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com