
【题目】今有化合物,甲:![]() 乙:
乙:![]() 丙:
丙:![]()
(1)甲、乙、丙之间是否互为同分异构体 ____(填“是”、“否”)请写出丙中含氧官能团的称:_______。
(2)写出只有一个侧链并且能水解的甲的同分异构体:___________
(3)请分别写出鉴别甲、乙、丙化合物的方法(指明所选试剂及主要现象即可)。
鉴别甲的方法:______________。
鉴别乙的方法:_____________________。
鉴别丙的方法:______________。
【答案】是 醛基、羟基 HCOOCH2C6H5 、CH3COOC6H5 、C6H5COOCH3 滴加三氯化铁溶液作用显紫色 滴加碳酸钠或碳酸氢钠溶液反应有气泡生成 滴加银氨溶液共热发生银镜反应孩与新制氢氧化铜共热有红色沉淀产生
【解析】
分子式相同、结构式不同的物质互为同分异构体;鉴别甲可以利用酚羟基的特殊性质如溴水或氯化铁溶液;鉴别乙可以利用羧基具有酸的化学性质;鉴别丙可以利用醛基的特殊性质如银氨溶液或新制的Cu(OH)2悬浊液,据此分析。
(1)分子式相同,而结构不同的化合物互为同分异构体,甲、乙和丙的分子式都是C8H8O2,所以互为同分异构体;根据丙的结构简式可知,分子中含氧官能团的名称醛基、羟基;
故答案为:是;醛基、羟基;
(2)甲的结构简式为![]() ,只有一个侧链并且能水解的甲的同分异构体应具有酯的结构,可能为:HCOOCH2C6H5 、CH3COOC6H5 、C6H5COOCH3;
,只有一个侧链并且能水解的甲的同分异构体应具有酯的结构,可能为:HCOOCH2C6H5 、CH3COOC6H5 、C6H5COOCH3;
故答案为:HCOOCH2C6H5 、CH3COOC6H5 、C6H5COOCH3;
(3)根据结构简式可知,甲中含有酚羟基和羰基、乙中含有羧基、丙中含有醛基和羟基,据此可以鉴别;即与三氯化铁溶液作用显色的是甲,与饱和溴水反应有白色沉淀生成的是甲;与碳酸钠溶液作用有气泡生成的是乙;与银氨溶液共热会发生银镜反应的是丙,与新制的Cu(OH)2悬浊液反应有红色沉淀产生的是丙。
故答案为:滴加三氯化铁溶液作用显紫色;滴加碳酸钠或碳酸氢钠溶液反应有气泡生成;滴加银氨溶液共热发生银镜反应或与新制氢氧化铜共热有红色沉淀产生。


科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种新兴化工原料,具有甲基化反应性能。
I.二甲醚的生产:二甲醚的生产原理之一是利用甲醇脱水成二甲醚,化学方程式如下:
反应i 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g) ΔH 1
CH3OCH3(g) + H2O(g) ΔH 1
(1)已知:甲醇、二甲醚的气态标准燃烧热分别为-761.5 kJ·mol-1、-1455.2 kJ·mol-1,且H2O(g) = H2O(l) ΔH=﹣44.0 kJ·mol﹣1。则反应i的ΔH 1=_________kJ·mol﹣1.
(2)反应i中甲醇转化率、二甲醚选择性的百分率与不同催化剂的关系如下表所示,生产时,选择的最佳催化剂是_________。
催化剂 | 甲醇转化率/% | 二甲醚选择性/% |
SiO2-TiO2/SO42- | 35.1 | 98.1 |
SiO2-TiO2/Fe3+ | 52.9 | 98.7 |
GSAL-108 | 81.0 | 98.1 |
SiO2-Al2O3 | 62.1 | 96.4 |
注:反应条件:常压、温度270℃,甲醇液体空速14mL/(g·h)
(3)选定催化剂后,测得平衡时的甲醇转化率与温度的关系如图所示。经研究产物的典型色谱图发现该过程主要存在的副反应为:
反应ii 2CH3OH(g) ![]() C2H4 (g)+2H2O(g) ΔH2=﹣29.1kJ·mol﹣1
C2H4 (g)+2H2O(g) ΔH2=﹣29.1kJ·mol﹣1
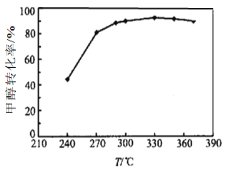
① 工业上生产二甲醚的温度通常在270-300℃,高于330℃之后,甲醇转化率下降。
根据化学平衡移动原理分析其原因可能是_________;
根据化学反应速率变化分析其原因可能是_________。
② 某温度下,以CH3OH(g)为原料,平衡时各物质的分压数据如下表:
物质 | CH3OH(g) | CH3OCH3(g) | C2H4 (g) | H2O(g) |
分压/MPa | 0.16 | 0.288 | 0.016 | … |
则反应i中,CH3OH(g)的平衡转化率α=_________。(用平衡分压代替平衡浓度计算;结果保留两位有效数字。)
II.二甲醚的应用:
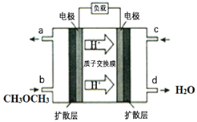
(4)下图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。该电池的负极反应式为:_________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应且正确的是( )
A. 乙醇与溴化氢的水溶液共热:CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
B. 甲烷和氯气在光照条件下的反应:2CH4+Cl2![]() 2CH3Cl+H2
2CH3Cl+H2
C. 苯酚溶液中滴入NaOH溶液:H++ OH-![]() H2O
H2O
D. 苯酚钠溶液中通入少量CO2:CO2+ H2O + 2C6H5O-![]() 2C6H5OH + 2CO32—
2C6H5OH + 2CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
A. 新戊烷与2,2二甲基丙烷的结构不同
B. 2,2,3,3四甲基丁烷在核磁共振谱(![]() )上有两组峰
)上有两组峰
C. CH2=CH—CH=CH—CH3和CH3CH2C≡CCH3可能共面的碳原子数都是5
D. C6H12分子中所有碳原子不可能共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应,CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
CH3OH(g) + H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
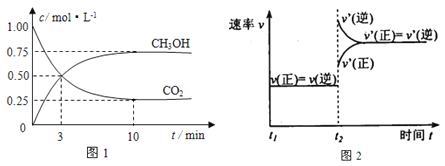
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=_________________。500℃达平衡时,CH3OH(g)的体积分数为_______,图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为____反应(填“放热”或“吸热”)。
(2)500℃该反应的平衡常数为_______(保留两位小数),若提高温度到800℃进行,达平衡时,K值_____(填“增大”“减小”或“不变”)。
(3)下列措施中不能使CO2的转化率增大的是________________。
A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.使用更有效的催化剂 E.将水蒸气从体系中分离出
(4)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0. 5mol/L,则此时v(正)_____v(逆)(填“>”“<”或“=”)。
(5)下列措施能使n(CH3OH)/n(CO2)增大的是______。
A.升高温度 B.在原容器中充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B都是芳香族化合物,1摩尔A水解得到1摩尔B和1摩尔醋酸。A、B的相对分子质量都不超过200,完全燃烧都只生成CO2和H2O,且B分子中碳和氢元素总的质量百分含量为65.2%。A的溶液具有酸性,不能使FeCl3溶液显色。
(1)A、B的分子量之差为____________
(2)A的分子式是___________________
(3)B可能的三种结构简式是____________ 、_____________ 、__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于四种装置的叙述不正确的是( )
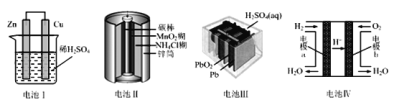
A.电池Ⅰ:正极发生的反应为2H++2e﹣═H2↑
B.电池Ⅱ:锌筒做负极,发生氧化反应
C.电池Ⅲ:是最早使用的充电电池,又称为二次电池
D.电池Ⅳ:外电路中电子由电极b通过导线流向电极a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。
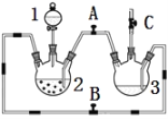
(1)稀硫酸应放在中___(填写仪器名称).
(2)本实验通过控制A、B、C三个开关将仪器中的空气排尽后,再关闭开关___、打开开关___,就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由___。
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是___。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为了洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是___
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
Ⅰ.滴定过程中发生反应的离子方程式为___。
Ⅱ.上表中第一次实验中记录数据明显大于后两次,其原因可能是___(填字母代号)。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴无气泡,滴定结束有气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
Ⅲ.通过实验数据计算的该产品纯度为___(用字母a、c表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五倍子是一种常见的中草药,其有效成分为X,在一定条件下X可分别转化为Y、Z。
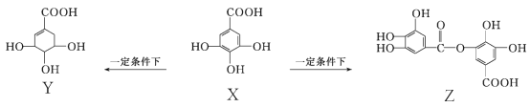
下列说法错误的是
A. 1 mol Z最多能与8 mol NaOH发生反应
B. 1 mol X与H2完全加成产物的分子式为C7H12O5
C. 向Y中滴加FeCl3溶液呈紫色
D. 1 mol Y与足量的金属钠反应放出2 mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com