
【题目】A、B、D、E、X、Y为元素周期表中六种主族元素,其原子序数依次增大。常温下,A2D呈液态;B是大气中含量最高的元素;E、X、Y原子最外层电子数相同,且E的最外层电子数比次外层电子数少1;过渡元素Z与D可形成多种化合物,其中红棕色粉末Z2D3常用作红色油漆和涂料。请用化学用语回答下列问题:
(1)A与D可形成既含极性键又含非极性键的化合物W,W的水溶液呈弱酸性,常用作无污染的消毒杀菌剂,W的电子式为______。
(2)向W溶液中加入ZE3,会减弱W的消毒杀菌能力,溶液呈现浅黄色。用化学方程式表示其原因是_________。
(3)将E2的水溶液加入浅绿色的ZE2溶液中发生反应的离子方程式是________。
(4)X和Y的单质,分别与H2化合时,反应剧烈程度强的是____(填化学式);从原子结构角度分析其原因是_____。
【答案】![]() 2H2O2
2H2O2![]() 2H2O+O2↑ Cl2+2Fe2+=2Cl-+2Fe3+ Br2 Br、I属于第ⅦA族(同一主族)元素,自上而下电子层数增加,非金属性减弱,反应的剧烈程度减弱
2H2O+O2↑ Cl2+2Fe2+=2Cl-+2Fe3+ Br2 Br、I属于第ⅦA族(同一主族)元素,自上而下电子层数增加,非金属性减弱,反应的剧烈程度减弱
【解析】
常温下,A2D呈液态,A2D是水,A是H元素、D是O元素;B是大气中含量最高的元素,B是N元素;E、X、Y原子最外层电子数相同,且E的最外层电子数比次外层电子数少1,则E是Cl、X是Br、Y是I;过渡元素Z与D可形成多种化合物,其中红棕色粉末Z2D3常用作红色油漆和涂料,Z2D3是氧化铁,Z是Fe元素。
(1)H与O形成的既含极性键又含非极性键的化合物W是过氧化氢,电子式为![]() ;
;
(2) ZE3是FeCl3,Fe3+催化分解过氧化氢,会减弱过氧化氢的消毒杀菌能力,化学方程式是2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(3)将氯水加入浅绿色的FeCl2溶液中,FeCl2被氧化为FeCl3,发生反应的离子方程式是Cl2+2Fe2+=2Cl-+2Fe3+;
(4) Br、I属于第ⅦA族(同一主族)元素,自上而下电子层数增加,非金属性减弱,反应的剧烈程度减弱,所以与H2化合时,Br2反应剧烈程度强。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示。下列有关说法正确的是

A.①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2
B.③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
C.③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
D.由上述实验可知:Cu在常温下既可与稀硝酸反应,也可与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某l00mL溶液可能含有Na+、NH4+、Fe3+、CO32 -、SO42 -、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )

A. 原溶液一定存在CO32 -和SO42 -,一定不存在Fe3+
B. 是否存在Na+只有通过焰色反应才能确定
C. 原溶液一定存在Na+,可能存在Cl-
D. 若原溶液中不存在Cl-,则c (Na+) =0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素主要化合价与原子序数的关系图,下列说法不正确的是( )
A. X和W位于同一主族
B. 原子半径:Y>Z>X
C. 盐YRX与化合物WX2的漂白原理相同
D. Y和R两者的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置为新型电池,放电时电池的总反应式为NaBr3+2Na2S2=3NaBr+Na2S4,下列说法正确的是( )
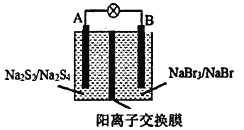
A.放电时A电极的反应式为2Na2S2+2e﹣═Na2S4+2Na+
B.放电时Na+从左向右通过阳离子交换膜
C.外电路中的电流方向为A→灯泡→B
D.放电时B电极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(4分)下列应用不涉及氧化还原反应的是( )
A. Na2O2用作呼吸面具的供氧剂
B. 工业上电解熔融状态的Al2O3制备Al
C. 工业上利用合成氨实现人工固氮
D. 实验室用NH4Cl和Ca(OH)2制备NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1 molL﹣1 CH3COOH溶液中逐滴加入0.1molL﹣1的NaOH溶液,溶液中由水电离出的OH﹣浓度在此滴定过程变化如图所示,下列说法正确的是( )

A.a~e点,e点时水的电离程度最大
B.b、d两点溶液的pH相同
C.c点表示酸碱恰好完全反应,溶液中c(OH﹣)═c(CH3COOH)+c(H+)
D.d点所示溶液中c(Na+)>c( CH3COOH)>c( CH3COO﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑩十种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ④ | ⑩ | |||||
3 | ⑤ | ⑥ | ⑦ | ③ | ⑧ | ⑨ | ||
回答下列问题:
(1)①、④按原子个数比1:1 组成的分子的电子式为____________________ ;由②、④两种元素组成的一种无毒化合物的结构式为 _____________________。
(2)这10种元素中,化学性质最不活泼的元素是_____________(填元素符号,下同),得电子能力最强的原子是__________________,失电子能力最强的单质与水反应的化学方程式是_________________________。
(3)用化学方程式表示②和⑨两种元素的非金属性强弱:________________________ 。
(4)元素③的气态氢化物和元素⑧的气态氢化物中,易于制备的是 ____________________(填化学式)
(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应,其离子方程式为 ______________________________。
(6)元素 ①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式:___________________ ;写出一种离子化合物的化学式:______________________。
(7)写出⑥的单质置换出②的单质的化学方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下可逆反应:A(s)+2B(g)![]() 2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是

A. 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减小
B. 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
C. 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
D. 保持温度不变,活塞P可自由移动,达到新的平衡后,乙中C的浓度和甲中C的浓度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com