
【题目】如图所示装置为新型电池,放电时电池的总反应式为NaBr3+2Na2S2=3NaBr+Na2S4,下列说法正确的是( )
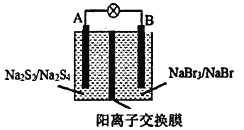
A.放电时A电极的反应式为2Na2S2+2e﹣═Na2S4+2Na+
B.放电时Na+从左向右通过阳离子交换膜
C.外电路中的电流方向为A→灯泡→B
D.放电时B电极发生氧化反应
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】已知下列事实不能用勒夏特列原理解释的是()
A.光照新制的氯水时,溶液的 pH 逐渐减小
B.氨水应密闭保存于低温处
C.打开汽水瓶时,有大量气泡逸出
D.高温高压有利于N2和H2转化为 NH3::N2(g)+3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS,某同学以该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:

已知:1.步骤①中发生的化学反应为非氧化还原反应 2.滤渣2的主要成分是SiO2和S,下列说法不正确的是
A. 步骤①,最好在通风橱中进行
B. 步骤①和③,说明CuS不溶于稀硫酸而ZnS溶于稀硫酸
C. 步骤③,涉及的离子反应为CuS+H2O2+2H+![]() Cu2++S+2H2O
Cu2++S+2H2O
D. 步骤②和④,均采用蒸发结晶的方式获取溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸钠稳定性远髙于次氯酸钠,也可用于杀菌消毒。制备次氯酸钠方法较多,常用的一种合成路线如下:

已知:1.次氯酸叔丁酯((CH3)3COCl),相对分子质量为108.5,是具有挥发性的黄色油状液体,密度为0.802g/mL,且有强烈刺激性臭味;2.(CH3)3COCl+LiOH=LiClO+(CH3)3COH
请回答:
(1)实验第一步的反应装置如图所示(夹持装置省略),B装置中支管的作用是___________;浓盐酸逐滴滴加而不是一次性加入的原因是_______________。

(2)请写出在装置A中发生反应的化学方程式___________________。
(3)对于操作1,下列说法不正确的是__________。
A.可以选用250mL规格的分液漏斗
B.操作1须在通风橱内进行
C.进行分液时,可提早关闭旋塞,以防止次氯酸叔丁酯从下口流出
D.装置B不合适进行操作1
(4)进行操作3时,并不是直接加热蒸发溶液,而是选择在40°C下缓慢蒸发溶液,试解释其原因 __________。
(5)该实验中次氯酸锂的产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.01mol·L-1MOH溶液的pH为10。已知:2MOH(aq)+H2SO4(aq)===M2SO4(aq)+2H2O(l) ΔH1=-24.2 kJ·mol-1;H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( )
A. +33.1 kJ·mol-1 B. +45.2 kJ·mol-1
C. -81.5 kJ·mol-1 D. -33.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、X、Y为元素周期表中六种主族元素,其原子序数依次增大。常温下,A2D呈液态;B是大气中含量最高的元素;E、X、Y原子最外层电子数相同,且E的最外层电子数比次外层电子数少1;过渡元素Z与D可形成多种化合物,其中红棕色粉末Z2D3常用作红色油漆和涂料。请用化学用语回答下列问题:
(1)A与D可形成既含极性键又含非极性键的化合物W,W的水溶液呈弱酸性,常用作无污染的消毒杀菌剂,W的电子式为______。
(2)向W溶液中加入ZE3,会减弱W的消毒杀菌能力,溶液呈现浅黄色。用化学方程式表示其原因是_________。
(3)将E2的水溶液加入浅绿色的ZE2溶液中发生反应的离子方程式是________。
(4)X和Y的单质,分别与H2化合时,反应剧烈程度强的是____(填化学式);从原子结构角度分析其原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组分子中,都由极性键构成的极性分子的一组是
A. C3H6和CO2 B. CCl4和H2S C. H2O和NH3 D. H2O2和CS2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.中和热的测定是高中重要的定量实验。取50mL 0.55mol/L的NaOH溶液与50mL 0.25mol/L的硫酸溶液置于如图所示的装置中进行中和热的测定实验,回答下列问题:

(1)仪器A的名称是____________。
(2)实验测得的数据如下表:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
2 | 25.9 | 25.9 | 25.9 | 29.2 | |
3 | 26.4 | 26.2 | 26.3 | 29.8 | |
近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。ΔH=__________ ( 取小数点后一位)。
(3)若改用60mL 0.25mol·L-1H2SO4和50mL 0.55mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量______,若实验操作均正确,则所求中和热_____。
II、某课外活动小组拟探究H+浓度对MnO2与H2O2反应速率的影响。
(4)现取等量MnO2和下表有关物质,在相同温度下进行4组实验,分别记录收集20.0mL氧气所需时间。
实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
水的体积/mL | 15 | 14.5 | V4 | 13.5 |
所需时间t/s | t1 | t2 | t3 | t4 |
已知酸条件下时:MnO2+H2O2+2H+=Mn2++O2↑+2H2O
①实验I发生反应的化学方程式为 ________,实验II中MnO2的作________。
②上表中V1=_______mL,V3=_______mL。
③若实验测得t2>t3>t4,则可得出的实验结论是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置进行中和热的测定,取50ml 0.50 mol/L 盐酸、50ml 0.55 mol/L NaOH溶液进行反应, 请回答下列问题:

(1)该装置还缺少的玻璃仪器为 _________________ ,若做1次完整的中和热测定实验,则温度计需使用_______ 次,
(2)倒入NaOH溶液的正确操作是______________。
A.一次迅速倒入 B.分三次少量倒入 C.沿玻璃棒缓慢倒入
(3)下列操作使测得中和热偏大的是_________
A.测量酸的温度后没有清洗温度计在测量碱 B.在量取盐酸时仰视读数
C. 使用铜棒搅拌反应液 D.将盐酸的体积量取为52.0ml
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com