
【题目】常温下,0.01mol·L-1MOH溶液的pH为10。已知:2MOH(aq)+H2SO4(aq)===M2SO4(aq)+2H2O(l) ΔH1=-24.2 kJ·mol-1;H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( )
A. +33.1 kJ·mol-1 B. +45.2 kJ·mol-1
C. -81.5 kJ·mol-1 D. -33.1 kJ·mol-1
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2+O2![]() 2SO3,△H<0下列措施能使反应物中活化分子百分数、化学平衡状态都发生变化的是( )
2SO3,△H<0下列措施能使反应物中活化分子百分数、化学平衡状态都发生变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() 2C(g)+3D(g)在四种不同情况下的反应速率如下,其中表示
2C(g)+3D(g)在四种不同情况下的反应速率如下,其中表示
反应速率最快的是
A. v(A)=0.20mol·L-1·min-1 B. v(B)=0.30 mol·L-1·min-1
C. v(C)=0.40 mol·L-1·min-1 D. v(D)=0.50 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)C离子的结构示意图为________。D在周期表中位置_________。
(2)写出E的电子式:____。
(3)A、D两元素形成的化合物属_____(填“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢气是一种理想的新能源,与化石燃料相比,氢能源有哪三大优点______、_____、____。
(2)4 g甲烷在氧气中燃烧生成CO2和液态水,放出222.5 kJ热量,写出甲烷燃烧的热化学方程式_________。
(3)拆开1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则合成氨反应的热化学方程式为_________。
(4)已知:H2 (g) + 1/2O2(g) =H2O (g) △H = -241.8 kJ /mol ;C (s) + O2(g) =CO2(g)△H = -393.5 kJ /mol;现有0.2 mol的炭粉和氢气组成的悬浮气,混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置为新型电池,放电时电池的总反应式为NaBr3+2Na2S2=3NaBr+Na2S4,下列说法正确的是( )
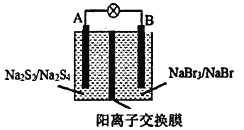
A.放电时A电极的反应式为2Na2S2+2e﹣═Na2S4+2Na+
B.放电时Na+从左向右通过阳离子交换膜
C.外电路中的电流方向为A→灯泡→B
D.放电时B电极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:
图甲 图乙
图乙
在图甲的圆底烧瓶内加入乙醇、浓硫酸和乙酸,加热回流一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
(1)图甲中冷凝水从________(填“a”或“b”)进,图乙中B装置的名称为__________。
(2)反应中加入过量的乙醇,目的是___________。
(3)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物,下列框图是分离操作步骤流程图:

则试剂a是_____,试剂b是________,分离方法Ⅲ是_____。
(4)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯得到乙酸乙酯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来。甲、乙两人蒸馏产物结果如下:甲得到了显酸性的酯的混合物,乙得到了大量水溶性的物质。丙同学分析了上述实验目标产物后认为上述实验没有成功。试解答下列问题:
①甲实验失败的原因是___________;
②乙实验失败的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.钠与水反应:Na+2H2O=Na++2OH-+H2↑
B.硫酸铝溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O
C.将氯气通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl-
D.将![]() 通入到
通入到![]() 溶液中:
溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Mg2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如下实验:

则关于原溶液的判断不正确的是
A.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B.无法确定原溶液中是否存在Cl-
C.肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D.肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com