
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)C离子的结构示意图为________。D在周期表中位置_________。
(2)写出E的电子式:____。
(3)A、D两元素形成的化合物属_____(填“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式:__________。
【答案】第三周期第ⅥA族 ![]()
![]() 共价 C+2H2SO4(浓)
共价 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
【解析】
根据B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E可知,E为过氧化钠,B元素为氧元素,C元素为钠元素。A原子的最外层上有4个电子且原子序数小于B(即氧元素),所以A为碳元素。D的L层电子数等于K、M两个电子层上的电子数之和,L层上有8个电子,K层上有2个电子,则M层上有6个电子,所以D元素为硫元素,据此解答。
(1)C元素为钠元素,C离子的结构示意图为![]() ,D为硫元素,S在周期表中位置是第三周期第ⅥA族;
,D为硫元素,S在周期表中位置是第三周期第ⅥA族;
(2)E为过氧化钠,E的电子式为:![]() ;
;
(3)A为碳元素,D为硫元素,A、D两元素形成的化合物为二硫化碳,属共价化合物;
(4)D为硫元素,D的最高价氧化物的水化物为硫酸,和碳反应的化学方程式为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。


科目:高中化学 来源: 题型:
【题目】根据原电池原理和电解原理进行如图回答。
请回答:
I 请根据图作答

(1)如图氢氧燃料电池的能量转化主要形式是________,在导线中电子流动方向用a___b(用“→”或“←”表示)。
(2)正极反应式为___________________________。
II 用如图所示装置进行实验(K闭合).

(3)Zn极为________极;实验过程中,SO42-________(填“从左向右”、“从右向左”或“不”)移动。
(4)y极的电极反应现象为________;Cu极的电极反应式为____________________。
(5)若想通过上图实现在铁上镀铜,则应该将y电极换成______(填铁或铜),AlCl3溶液换成___________溶液。
III(6)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HClNH4Cl为电解质溶液制取新型燃料电池,请写出该电池的正极反应式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____(填字母)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)c(OH﹣) D.c(OH-)/c(H+) E.![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___________。
(4)25℃时,将a mol/L的醋酸与b mol/L氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为_____。
(5)标准状况下,将1.12L CO2通入100mL 1mol/L的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH-)=2c(H2CO3)+___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS,某同学以该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:

已知:1.步骤①中发生的化学反应为非氧化还原反应 2.滤渣2的主要成分是SiO2和S,下列说法不正确的是
A. 步骤①,最好在通风橱中进行
B. 步骤①和③,说明CuS不溶于稀硫酸而ZnS溶于稀硫酸
C. 步骤③,涉及的离子反应为CuS+H2O2+2H+![]() Cu2++S+2H2O
Cu2++S+2H2O
D. 步骤②和④,均采用蒸发结晶的方式获取溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,A、B两个装置中两个烧杯分别盛有足量的CuSO4溶液:
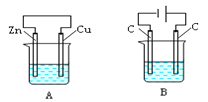
(1)A、B两个装置中属于原电池的是_____(填标号,下同),属于电解池的是____。
(2)A池中Zn是___极,发生______(填氧化或还原)反应,电极反应式为____________; Cu极电极反应式为_______;A中总反应的离子方程式为__________。
(3)B池中左边C是___极,发生______(填氧化或还原)反应,电极反应式____________;右边C极电极反应式为_________;B中总反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸钠稳定性远髙于次氯酸钠,也可用于杀菌消毒。制备次氯酸钠方法较多,常用的一种合成路线如下:

已知:1.次氯酸叔丁酯((CH3)3COCl),相对分子质量为108.5,是具有挥发性的黄色油状液体,密度为0.802g/mL,且有强烈刺激性臭味;2.(CH3)3COCl+LiOH=LiClO+(CH3)3COH
请回答:
(1)实验第一步的反应装置如图所示(夹持装置省略),B装置中支管的作用是___________;浓盐酸逐滴滴加而不是一次性加入的原因是_______________。

(2)请写出在装置A中发生反应的化学方程式___________________。
(3)对于操作1,下列说法不正确的是__________。
A.可以选用250mL规格的分液漏斗
B.操作1须在通风橱内进行
C.进行分液时,可提早关闭旋塞,以防止次氯酸叔丁酯从下口流出
D.装置B不合适进行操作1
(4)进行操作3时,并不是直接加热蒸发溶液,而是选择在40°C下缓慢蒸发溶液,试解释其原因 __________。
(5)该实验中次氯酸锂的产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.01mol·L-1MOH溶液的pH为10。已知:2MOH(aq)+H2SO4(aq)===M2SO4(aq)+2H2O(l) ΔH1=-24.2 kJ·mol-1;H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( )
A. +33.1 kJ·mol-1 B. +45.2 kJ·mol-1
C. -81.5 kJ·mol-1 D. -33.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组分子中,都由极性键构成的极性分子的一组是
A. C3H6和CO2 B. CCl4和H2S C. H2O和NH3 D. H2O2和CS2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是
A.1molCH4中含有的电子数为8NA
B.2L0.3mol·L-1的硫酸钾溶液中钾离子的物质的量为0.6NA
C.常温常压下,32gO2和O3的混合气体所含原子数为2NA
D.标准状况下,22.4LH2O所含的分子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com