
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是
A.1molCH4中含有的电子数为8NA
B.2L0.3mol·L-1的硫酸钾溶液中钾离子的物质的量为0.6NA
C.常温常压下,32gO2和O3的混合气体所含原子数为2NA
D.标准状况下,22.4LH2O所含的分子数为NA
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)C离子的结构示意图为________。D在周期表中位置_________。
(2)写出E的电子式:____。
(3)A、D两元素形成的化合物属_____(填“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.钠与水反应:Na+2H2O=Na++2OH-+H2↑
B.硫酸铝溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O
C.将氯气通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl-
D.将![]() 通入到
通入到![]() 溶液中:
溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产或实验事实引出的相应结论不正确的是( )
选项 | 事实 | 结论 |
A | 工业制硫酸中,在矿石处理阶段,将矿石粉碎再煅烧 | 增大反应物的接触面积,加快化学反应速率 |
B | A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入MnO2,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
C | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
D | 一定条件下:H2(g)+I2(g) | c(I2)增大,I2物质的量增多 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是中学化学常见的三种物质,它们之间的相互转化关系如下![]() 、Y、Z、E、F为英文字母,部分反应条件及产物略去
、Y、Z、E、F为英文字母,部分反应条件及产物略去![]()

I.若Y是一种易溶于水,且能使品红溶液褪色的无色刺激性气味的气体。
(1)则Y和新制氯水主要成分反应生成两种强酸的化学方程式______________。
(2) Y气体的大量排放会形成酸雨,在工业上可以用足量氨水吸收,化学方程式为________________。
(3)Z的水溶液可以制得某种强酸E。实验室用![]() 的浓
的浓![]() 溶液配制
溶液配制![]() 稀E溶液
稀E溶液![]() 。
。
①制该稀E溶液需要使用的玻璃仪器有胶头滴管、量筒、烧杯、____和_____;
②算所需E浓溶液的体积为___mL(保留1位小数)。
II.若Z是淡黄色固体粉末。在呼吸面具或潜水艇中由Z和CO2制备氧气的化学反应方程式为____。
III.若Z是红棕色气体。
(1)试写出Z与水反应制备另一种强酸F的化学方程式_______。
(2)2.0g铜镁合金完全溶解于![]() 密度为
密度为![]() 质量分数为
质量分数为![]() 的浓F溶液中,得到Z和
的浓F溶液中,得到Z和![]() 和
和![]() 均为浓F溶液的还原产物
均为浓F溶液的还原产物![]() 的混合气体
的混合气体![]() 标准状况
标准状况![]() ,向反应后的溶液中加入
,向反应后的溶液中加入![]() 溶液,当金属离子全部沉淀,得到
溶液,当金属离子全部沉淀,得到![]() 沉淀。则合金中铜与镁的物质的量之比为_____,加入NaOH溶液的体积为_____mL。
沉淀。则合金中铜与镁的物质的量之比为_____,加入NaOH溶液的体积为_____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1CH3COOH溶液的滴定曲线如图所示。下列说法正确的是

A. 点①所示溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
B. 点②所示溶液中:c(Na+)+c(H+)=c(CH3COO-) +c(CH3COOH) +c(OH-)
C. 点③所示溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D. 在整个滴定过程中:溶液中![]() 始终不变
始终不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Mg2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如下实验:

则关于原溶液的判断不正确的是
A.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B.无法确定原溶液中是否存在Cl-
C.肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D.肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见烃,是一种水果催熟剂;草莓、香蕉中因为含有F而具有芳香味。现以A为主要原料合成F,其合成路线如下图所示。

(1)A的结构简式为____;D中官能团名称为____。
(2)写出反应①的化学方程式:____________________。
(3)写出反应②的化学方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1871年门捷列夫最早预言了类硅元素锗,锗元素在元素周期表中与硅元素同族,并位于硅的下一周期。1886年德国化学家温克勒发现和分离了锗元素,并以其祖国的名字命名为“Ge”。锗是重要的的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。
已知:①丹宁是一种有机沉淀剂,可与四价锗络合形成沉淀:
②GeCl4易水解,在浓盐酸中溶解度低。
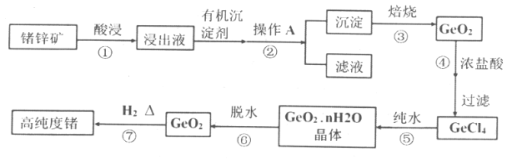
(1)锗元素的原子序数为:___________;锗元素在元素周期表中的位置是:_____________。
(2)GeCl4的结构与SiCl4相似,写出GeCl4的电子式:_______________。
(3)简述步骤①中提高酸浸效率的措施____________、_____________(写两种)。
(4)步骤②操作A是___________(填操作名称)。
(5)步骤③中的物质在___________(填仪器名称)中加热。
(6)步骤④不选用稀盐酸,而选用浓盐酸的原因可能是__________、________(写出两点)。
(7)写出步骤⑤的化学方程式________________。
写出步骤⑦的化学方程式________________。
(8)请写出一种证明步骤⑦反应完全的操作方法__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com