
 ;没有支链且能被氧化成醛,则为1-丁醇,与乙酸发生酯化反应生成酯和水,该反应为CH3COOH+CH3CH2CH2CH2OH
;没有支链且能被氧化成醛,则为1-丁醇,与乙酸发生酯化反应生成酯和水,该反应为CH3COOH+CH3CH2CH2CH2OH| 浓硫酸 |
| △ |
 ;CH3COOH+CH3CH2CH2CH2OH
;CH3COOH+CH3CH2CH2CH2OH| 浓硫酸 |
| △ |


科目:高中化学 来源: 题型:
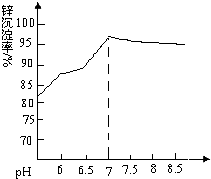 纳米氧化锌是一种新型高功能精细无机产品,由粗氧化锌(含杂质Al2O3、FeO、Fe2O3、CuO等)制备纳米氧化锌.流程依次涉及的部分离子方程式:①FeO+2H+=Fe2++H2O ②H2O2+2Fe2++2H+=2Fe3++2H2O ③Zn+Cu2+=Zn2++Cu
纳米氧化锌是一种新型高功能精细无机产品,由粗氧化锌(含杂质Al2O3、FeO、Fe2O3、CuO等)制备纳米氧化锌.流程依次涉及的部分离子方程式:①FeO+2H+=Fe2++H2O ②H2O2+2Fe2++2H+=2Fe3++2H2O ③Zn+Cu2+=Zn2++Cu| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ | Al3+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 | 3.7 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 | 4.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
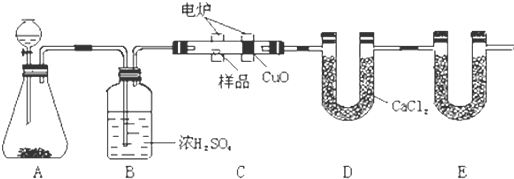
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
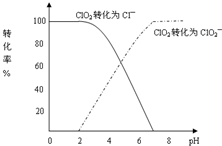 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水中ClO2-的含量应不超过0.2mg?L-1.饮用水中CIO2、CIO2-的含量可用连续碘量法进行测定.CIO2被I-还原为CIO2-、Cl-的转化率与溶液pH的关系如图所示.当pH≤2.0时,CIO2-也能被I-完全还原成Cl-.反应生成的I2用标准Na2S2O3溶液滴定:
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水中ClO2-的含量应不超过0.2mg?L-1.饮用水中CIO2、CIO2-的含量可用连续碘量法进行测定.CIO2被I-还原为CIO2-、Cl-的转化率与溶液pH的关系如图所示.当pH≤2.0时,CIO2-也能被I-完全还原成Cl-.反应生成的I2用标准Na2S2O3溶液滴定:查看答案和解析>>
科目:高中化学 来源: 题型:

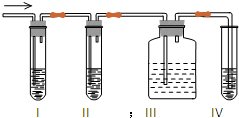
查看答案和解析>>
科目:高中化学 来源: 题型:
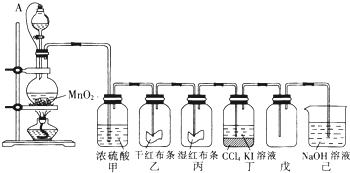
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、950 mL 111.2 g |
| B、500 mL 117.0g |
| C、1000 mL 117.0 g |
| D、1000 mL 111.2 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com