
【题目】下列反应中属于氧化还原反应的是
A.CuSO4+H2S=CuS↓+H2SO4B.2FeCl3+Cu=2FeCl2+CuCl2
C.Cu2(OH)2CO3![]() 2CuO+CO2↑+H2OD.FeCl3+3NaOH=Fe(OH)3↓+3NaCl
2CuO+CO2↑+H2OD.FeCl3+3NaOH=Fe(OH)3↓+3NaCl
科目:高中化学 来源: 题型:
【题目】二氧化碳的有效回收利用,既能缓解能源危机,又可减少温室效应的影响,具有解决能源问题及环保问题的双重意义。Zn/ZnO热化学循环还原CO2制CO的原理如下图所示,回答下列问题:

(1)①从循环结果看,能量转化的主要方式是______________ ;
②反应2CO2(g)=2CO(g)+O2(g) △H=_________kJ/mol。
③Zn/ZnO在反应中循环使用,其作用是__________________
(2)二甲醚是主要的有机物中间体,在一定条件下利用CO2与H2可直接合成二甲醚:2CO2(g) +6H2(g)![]() CH3OCH3(g)+3H2O(g) ,
CH3OCH3(g)+3H2O(g) ,![]() =3时,实验测得CO2的平衡转化率随温度及压强变化如下图所示。
=3时,实验测得CO2的平衡转化率随温度及压强变化如下图所示。
①该反应的△H =______0(填“>”或“<”)。
②图中压强(P)由大到小的顺序是__________________。
③若在1L密闭容器中充入0.2molCO2和0.6molH2,CO2的平衡转化率对应下图中A点,则在此温度,该反应的化学平衡常数是___________(保留整数)。
④合成二甲醚过程中往往会生成一氧化碳,合成时选用硅铝化合物做催化剂,硅铝比不同时,生成二甲醚或一氧化碳的物质的量分数不同。硅铝比与产物选择性如下图所示。图中A点和B点的化学平衡常数比较:KA____KB(填“>、<、=”)。根据以上两条曲线,写出其中一条变化规律:_______________________。

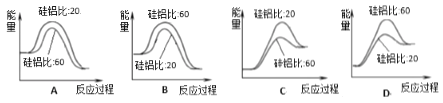
⑤上图是使用不同硅铝比化合物做催化剂制备二甲醚的能量变化示意图,其中正确且最佳的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质所含原子个数按由大到小的顺序排列的是
①标况下11.2L NH3②1molHe③9gH2O④1.204×1023个H3PO4
A.①④③②B.④③②①C.②③④①D.①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产、生活中有广泛的应用。
(1)复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解制氢气,原理如下:
①MnFe2O4(s)===MnFe2O(4-x)(s)+x/2O2(g) ΔH1
②MnFe2O(4-x)(s)+xH2O(g)===MnFe2O4(s)+xH2(g) ΔH2
③2H2O(g)===2H2(g)+O2(g) ΔH3
则:ΔH3与ΔH1、ΔH2的关系为ΔH3=________。
(2)纳米铁是重要的储氢材料,可用下列反应制得:Fe(s)+5COFe(CO)5(g) ΔH<0。在1 L恒容密闭容器中加入足量铁粉和0.5 mol CO,在T1、T2不同温度下进行反应,测得c(CO)与温度、时间的关系如图1所示。

①T1________(填“>”或“<”)T2。
②T2温度下,上述反应的平衡常数K=________(结果不要求带单位)。
(3)高铁酸钾(K2FeO4)被人们称为“绿色化学”净水剂。高铁酸钾在酸性至弱碱性条件下不稳定。
①工业上用KClO与Fe(NO3)3溶液反应制得K2FeO4,反应的离子方程式为____________________。制备K2FeO4时,KClO饱和溶液与Fe(NO3)3饱和溶液混合的操作为________________________。
②已知K2FeO4在水解过程中铁元素形成的微粒分布分数与pH的关系如图所示。


向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为____________________________________。
(4)电解法可制得K2FeO4,装置如图所示。阳极的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的CO和CO2相比,下列叙述中正确的是
A.所含碳原子数比为1:1 B.体积比为7:11
C.密度比为7:11 D.分子数比为7:11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子半径依次增大,X是短周期元素中原子半径最小的,Z、W同主族,且Z、W的原子序数之差与Y的原子序数相同,X、Y、Z、W的最外层电子数之和为15。下列说法正确的是( )
A. Z单质与WYZ在高温条件下反应生成W单质,说明非金属性:Z>W
B. 向无色的X2Z2Y4溶液中滴加少量酸性高锰酸钾溶液,溶液仍为无色,体现了X2Z2Y4的还原性
C. Y、Z、W的简单氢化物的稳定性依次增强
D. 由X、Y两种元素形成的所冇化合物中所含化学键的类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统接触法制取硫酸能耗大,污染严将燃料电池引人硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能。以燃料电池为电源电解硫酸铜溶液的工作原理示意图如下所示。

下列说法不正确的是( )
A. b极为正极,电极反应式为O2+4H++4e-=2H20
B. H+由a极通过质子交换膜向b极移动
C. 该燃料电池的总反应式为2SO2+O2+2H2O=2H2SO4
D. 若a极消耗2.24 L(标准状况)SO2,理论上c极,有6.4g铜析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示:自催化作用是指反应产物之一使该反应速率加快的作用。用稀硫酸酸化的KMnO4进行下列三组实验,一段时间后溶液均褪色(0.01mol/L可以记做0.01M)。
实验① | 实验② | 实验③ |
|
|
|
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A. 实验①中发生氧化还原反应,H2C2O4是还原剂,产物MnSO4能起自催化作用
B. 实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C. 实验③褪色比①快,是因为Cl—的催化作用加快了反应速率
D. 若用1mL0.2M的H2C2O4做实验①,推测比实验①褪色快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法错误的是
A. 12.5mL 16mol/L浓硫酸与足量锌充分反应,转移电子数为0.2NA
B. 5.8g熟石膏(2CaSO4 H2O)含有的结晶水分子数为0.02NA
C. 92.0g甘油(丙三醇)和甲苯的混合物中含氢原子数为8.0NA
D. 标准状况下,1L甲醛气体完全燃烧消耗O2分子个数约为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com