
【题目】有以下一系列反应,最终产物为草酸(乙二酸)。
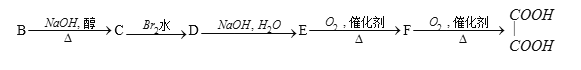
已知B为某一溴代物。
(1)推测用字母代表的化合物的结构简式:C____________ F ____________
(2)写出化学方程式:B→C_________________________E→F_______________
(3)E和草酸在一定条件下生成的环状化合物的结构简式为____________________
【答案】CH2=CH2 OHCCHO CH3CH2Br+NaOH![]() CH2=CH2+NaBr+H2O HOCH2CH2OH+O2
CH2=CH2+NaBr+H2O HOCH2CH2OH+O2![]() OHCCHO+2H2O
OHCCHO+2H2O 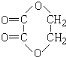
【解析】
根据反应流程分析可知,F被氧化生成乙二酸,则F是乙二醛,其结构简式为OHCCHO,E被氧化生成F,则E是乙二醇,其结构简式为HOCH2CH2OH,B是一溴代物,B发生消去反应生成C,C和溴水发生加成反应生成D,D发生取代反应生成E,则这几种分子中的碳原子个数相同,所以B是1-溴乙烷,其结构简式为CH3CH2Br,C是CH2=CH2,D是CH2BrCH2Br,据此可分析解答问题。
(1)通过上述分析可知,C是乙烯,其结构简式为CH2=CH2,,F是乙二醛,其结构简式为OHCCHO,故答案为:CH2=CH2;OHCCHO;
(2)B是1-溴乙烷,C是乙烯,B发生消去反应生成C,反应方程式为:CH3CH2Br+NaOH![]() CH2=CH2+NaBr+H2O,E是乙二醇,F是乙二醛,E在Cu作催化剂加热的条件下被氧化生成F,反应方程式为:HOCH2CH2OH+O2
CH2=CH2+NaBr+H2O,E是乙二醇,F是乙二醛,E在Cu作催化剂加热的条件下被氧化生成F,反应方程式为:HOCH2CH2OH+O2![]() OHCCHO+2H2O,故答案为:CH3CH2Br+NaOH
OHCCHO+2H2O,故答案为:CH3CH2Br+NaOH![]() CH2=CH2+NaBr+H2O;HOCH2CH2OH+O2
CH2=CH2+NaBr+H2O;HOCH2CH2OH+O2![]() OHCCHO+2H2O;
OHCCHO+2H2O;
(3)乙二醇和乙二酸在浓硫酸加热的条件下可发生酯化反应生成环酯,该环酯的结构简式为 ,故答案为:
,故答案为: 。
。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
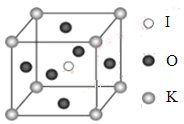
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g);△H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol。试回答下列问题:
2SO3(g);△H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol。试回答下列问题:
(1)反应进行到t1时,SO2的体积分数为__;
(2)若在t1时充入一定量的氩气(Ar),SO2的物质的量将__(填“增大”、“减小”或“不变”);
(3)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量_2.1mol(填“<”、“>”或“=”),简单说明原因:__。
(4)若t1达到平衡后,保持容器的体积不再变化。再加入0.2molSO2、0.1molO2和1.8molSO3,此时v逆_v正(填“<”、“>”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铜易溶于水,在130 ℃时会发生分解反应,是一种燃烧催化剂。以食盐等为原料制备高氯酸铜[Cu(ClO4)2·6H2O]的一种工艺流程如图1所示:
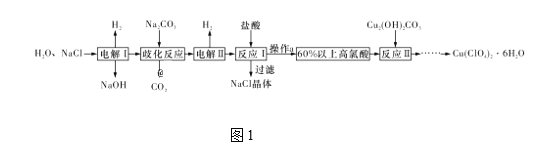
(1)发生“电解Ⅰ”时,所用的交换膜是____(填“阳”或“阴”)离子交换膜。
(2)歧化反应是同一种物质中同种元素自身的氧化还原反应。已知上述工艺流程中“歧化反应”的产物之一为氯酸钠,则“歧化反应”的化学方程式为________。
(3)“电解Ⅱ”主要的阳极产物是_________(填离子符号)。
(4)操作a的名称是____。
(5)用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a t,最终制得Cu(ClO4)2·6H2O为b t,则产率为____ (用含a,b的代数式表示)。
(6)某温度下,高氯酸铜[Cu(ClO4)2]按A、B两种方式同时分解,分解过程中铜的化合价不发生改变。方式A为Cu(ClO4)2![]() CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50% 的方式完全分解,且A、B两种方式转移的电子数之比为8∶7,则方式B为____ (用化学方程式表示)。
CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50% 的方式完全分解,且A、B两种方式转移的电子数之比为8∶7,则方式B为____ (用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中成药连花清瘟胶囊在对抗 H1N1病毒中发挥重大作用,其有效成分绿原酸的结构简式如图,下列有关说法错误的是

A. 绿原酸属于芳香族化合物
B. 分子中至少有 7 个碳原子共面
C. 1mol 绿原酸最多可消耗 5mol NaOH
D. 与绿原酸苯环上取代基种类及个数均相同的有机物有5 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应ClO3—+3HSO3—=3SO42—+Cl-+3H+。已知该反应的反应速率随c(H+)的增大而增大。如图所示为用ClO3—在单位时间内物质的量浓度变化表示的该反应的υ-t图。下列说法不正确的是( )
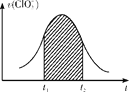
A.反应开始时速率增大可能是c(H+)增大所致
B.纵坐标为υ(Cl-)的υ-t曲线与图中曲线完全重合
C.图中阴影部分的面积表示t1~t2时间内ClO3—的物质的量的减少量
D.后期反应速率下降的主要原因是反应物浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。下列说法正确的是

A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡增大c(Cu2+),c(Cl—)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl—(aq)
Cu2+(aq)+Cl—(aq)![]() CuCl(s)的ΔH=(a+2b) kJ·mol-1
CuCl(s)的ΔH=(a+2b) kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com