
【题目】高氯酸铜易溶于水,在130 ℃时会发生分解反应,是一种燃烧催化剂。以食盐等为原料制备高氯酸铜[Cu(ClO4)2·6H2O]的一种工艺流程如图1所示:
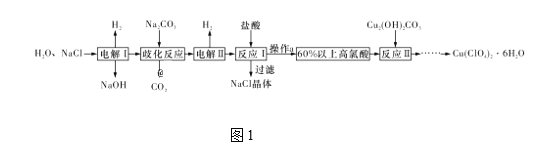
(1)发生“电解Ⅰ”时,所用的交换膜是____(填“阳”或“阴”)离子交换膜。
(2)歧化反应是同一种物质中同种元素自身的氧化还原反应。已知上述工艺流程中“歧化反应”的产物之一为氯酸钠,则“歧化反应”的化学方程式为________。
(3)“电解Ⅱ”主要的阳极产物是_________(填离子符号)。
(4)操作a的名称是____。
(5)用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a t,最终制得Cu(ClO4)2·6H2O为b t,则产率为____ (用含a,b的代数式表示)。
(6)某温度下,高氯酸铜[Cu(ClO4)2]按A、B两种方式同时分解,分解过程中铜的化合价不发生改变。方式A为Cu(ClO4)2![]() CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50% 的方式完全分解,且A、B两种方式转移的电子数之比为8∶7,则方式B为____ (用化学方程式表示)。
CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50% 的方式完全分解,且A、B两种方式转移的电子数之比为8∶7,则方式B为____ (用化学方程式表示)。
【答案】阳 3Na2CO3+3Cl2===5NaCl+NaClO3+3CO2 ClO4- 蒸发浓缩 ![]() 100% 2Cu(ClO4)2
100% 2Cu(ClO4)2![]() 2CuO+7O2↑+2Cl2↑
2CuO+7O2↑+2Cl2↑
【解析】
根据题意可知,本题考查电化学原理,运用原电池和电解池原理分析。
(1)“电解I”所发生的反应是电解氯化钠溶液生成氢氧化钠、氢气和氯气,需要防止氢氧根离子与氯气反应,所以用的交换膜是阳离子交换膜;
故答案为:阳;
(2)“歧化反应”是碳酸钠与氯气反应生成氯化钠和NaClO3,氯元素从0价变为1价和+5价,同时生成二氧化碳,反应的化学方程式为3Na2CO3+3Cl2===5NaCl+NaClO3+3CO2;
故答案为:3Na2CO3+3Cl2===5NaCl+NaClO3+3CO2;
(3)通过电解,溶液中氯酸根离子失电子发生氧化反应在阳极生成高氯酸根离子,“电解II”的阳极的氯离子失电子产物为ClO4-;
故答案为:ClO4-;
(4)加入盐酸,过滤除去氯化钠晶体,通过蒸发浓缩即可得到60%以上的高氯酸,
故答案为:蒸发浓缩;
(5)根据流程图,氯化钠电解生成的氯气与碳酸钠反应生成氯酸钠和氯化钠,电解后氯酸钠变成高氯酸钠,加入盐酸反应生成高氯酸,最后与Cu2(OH)2CO3反应生成Cu(ClO4)26H2O,假设起始是氯化钠为6mol,则生成的氯气为3mol,得到1mol氯酸钠,根据氯元素守恒最终可以得到0.5molCu(ClO4)26H2O,因此产率为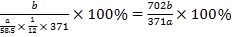 ;
;
故答案为:![]() 100%;
100%;
(6)在A方式:![]() 中CuCl2是还原产物,O2是氧化产物,反应中转移电子数为16e,若4mol高氯酸铜在该温度下按A、B各占50%的方式完全分解,则方式A共转移4mol×16e=64mole,A、B两种方式转移的电子数之比为8:7,则B中转移电子64mole×
中CuCl2是还原产物,O2是氧化产物,反应中转移电子数为16e,若4mol高氯酸铜在该温度下按A、B各占50%的方式完全分解,则方式A共转移4mol×16e=64mole,A、B两种方式转移的电子数之比为8:7,则B中转移电子64mole×![]() =56mole,Cu(ClO4)2分解时Cu元素化合价不变,则B方式中O2是氧化产物,生成O2的物质的量为
=56mole,Cu(ClO4)2分解时Cu元素化合价不变,则B方式中O2是氧化产物,生成O2的物质的量为![]() ,若Cl元素还原产物中价态为x价,则8(7x)=56,解得:x=0,可知还原产物为Cl2,且其物质的量为
,若Cl元素还原产物中价态为x价,则8(7x)=56,解得:x=0,可知还原产物为Cl2,且其物质的量为![]() ,则结合原子守恒,B方式发生反应的方程式为2Cu(ClO4)2
,则结合原子守恒,B方式发生反应的方程式为2Cu(ClO4)2![]() 2CuO+7O2↑+2Cl2↑;
2CuO+7O2↑+2Cl2↑;
故答案为:2Cu(ClO4)2![]() 2CuO+7O2↑+2Cl2↑。
2CuO+7O2↑+2Cl2↑。


科目:高中化学 来源: 题型:
【题目】(1)卤族元素组成的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识它们。
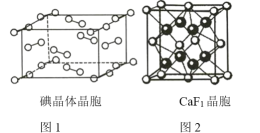
①如图1为碘晶体的晶胞结构。有关说法正确的是_________(填序号)。
a.平均每个晶胞中有4个碘分子
b.平均每个晶胞中有4个碘原子
c.碘晶体为无限延伸的空间结构,是原子晶体
d.碘晶体中存在的相互作用有非极性键和范德华力
②已知CaF2晶胞(图2)的密度为ρ g/cm3,NA表示阿伏加德罗常数的值,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的摩尔质量可表示为_________________。
(2)以MgCl2为原料用电解熔融盐法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外,还有_______________。
(3)有研究表明,化合物X可用于研究模拟酶,当结合 或Cu(I)(I表示化合价为+1)时,分别形成如下图所示的A和B:
或Cu(I)(I表示化合价为+1)时,分别形成如下图所示的A和B:

①A中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有_________键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较A和B中微粒间相互作用力的差异:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CPAE是蜂胶的主要活性成分,也可由咖啡酸合成,下列说法不正确的是( )

A. 1mol CPAE与足量的溴水反应,最多消耗4mol Br2
B. 咖啡酸可发生聚合反应,而且其分子中含有3种官能团
C. 与苯乙醇互为同分异构体的酚类物质共有9种
D. 可用金属Na检测上述反应是否残留苯乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下一系列反应,最终产物为草酸(乙二酸)。
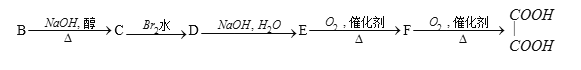
已知B为某一溴代物。
(1)推测用字母代表的化合物的结构简式:C____________ F ____________
(2)写出化学方程式:B→C_________________________E→F_______________
(3)E和草酸在一定条件下生成的环状化合物的结构简式为____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五倍子是一种常见的中草药,其有效成分为X。一定条件下X可分别转化为Y、Z,如下所示。
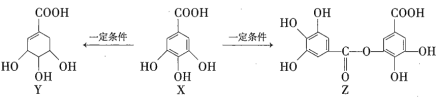
下列说法错误的是( )
A.![]() 最多能与
最多能与![]() 发生取代反应
发生取代反应
B.等物质的量的Z分别与Na和![]() 恰好反应时,消耗Na和
恰好反应时,消耗Na和![]() 的物质的量之比为6∶1
的物质的量之比为6∶1
C.一定条件下,Y能发生加成反应、取代反应、消去反应和氧化反应
D.![]() 最多能与
最多能与![]() 发生反应
发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验证明,在![]() 溶液中慢慢加入浓的NaOH溶液,开始有蓝色沉淀产生,但是当加入的浓NaOH溶液过量后,沉淀溶解变成深蓝色溶液,某学生对此作出了推断。下列推断正确的是( )
溶液中慢慢加入浓的NaOH溶液,开始有蓝色沉淀产生,但是当加入的浓NaOH溶液过量后,沉淀溶解变成深蓝色溶液,某学生对此作出了推断。下列推断正确的是( )
A.形成了![]() 配离子
配离子
B.![]() 溶液的颜色被冲淡
溶液的颜色被冲淡
C.形成了![]() 配离子
配离子
D.![]() 存在溶解平衡
存在溶解平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物的结构简式如图所示,下列有关该物质的说法正确的是( )
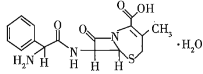
A.在一定条件下,该物质能发生水解反应生成氨基酸
B.1 mol该物质最多能与7 mol H2发生加成反应
C.该物质能与碳酸钠反应,不能与盐酸反应
D.该物质不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,△H1=-393.5 kJmol-1,△H2=-395.4 kJmol-1,下列说法或表示式正确的是
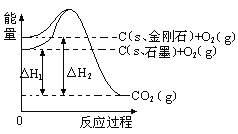
A.石墨和金刚石的转化是物理变化
B.1mol石墨的总能量比1 mol金刚石的总能量大1.9 kJ
C.金刚石的稳定性强于石墨
D.C(s、石墨)=C(s、金刚石) △H=" +1.9" kJmol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com