
【题目】(1)实验证明,聚沉能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,聚沉能力越大。
①向Fe(OH)3胶体中加入下列电解质时,其聚沉能力最强的为________(填序号)。
A.NaCl B.FeCl3 C.K2SO4 D.Na3PO4
②为了把黏土溶胶(黏土胶体粒子带负电荷)变成较洁净的水,加入下列电解质时,_______(填序号)效果最明显,原因是_____________________________________________。
A.BaCl2 B.Al2(SO4)3 C.KCl D.CuSO4
(2)已知半透膜有非常细小的孔,只允许较小的离子、分子通过,胶体粒子不能透过。(提示:碘遇淀粉显蓝色)
把10 mL淀粉胶体和5 mL KCl溶液的混合液体加入到用半透膜制成的袋内,将此袋浸入盛蒸馏水的烧杯中,2 min后,用两支试管各取5 mL烧杯中的液体,并做如下实验:
①向其中一支试管里滴加少量AgNO3溶液,其现象是______________________。
②向另一支试管里滴加少量碘水,其现象是__________________________。
③由上述实验得出的结论是__________________________________________。
科目:高中化学 来源: 题型:
【题目】(1)根据杂化轨道理论判断下列分子的空间构型是V形的是_____(填序号)。
a . BeCl2 b . H2O c . HCHO d . CS2
(2)己知AlCl3的沸点:1 90 ℃ (2.5个大气压),但是它在178 ℃ 就开始升华,则AlCl3的晶体类型为_______;为什么工业上一般不采用电解熔融氯化铝的方法制备金属铝________。 (3)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T 比Q 多2。T的基态原子外围电子(价电子)排布式为__________, Q2+的未成对电子数是______。
(4)下图是从NaCl或CsCl晶体结构图中分割出来的部分结构图,判断NaCl晶体结构的图象是下图中的_______(填序号)。

(5)[Cu(NH3)4]2+配离子中存在的化学键类型有_______(填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
已知:[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3 被两个Cl-取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___________。
(6)X与Y可形成离子化合物,其晶胞结构如图所示,其中X和Y的相对原子质量分别为a 和b,晶体密度为pg · cm-3,则晶胞中距离最近的X、Y之间的核间距离是_____cm 。( NA表示阿伏伽德罗常数,用含p、a、b、N的代数式表达)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是无机物A~F在一定条件下的转化关系(部分产物及反应条件未标出)。其中A为气体,A~F 都含有相同的元素。
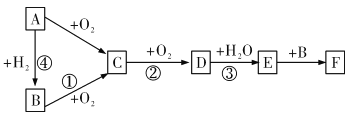
试回答下列问题:
(1)写出下列物质的化学式:C_______、F_______。
(2)在反应①中,34gB发生反应后放出452.9kJ的热量,请写出该反应的热化学方程式________。
(3)③的化学方程式为__________,该反应氧化剂与还原剂的物质的量之比为______。
(4)铜与E的浓溶液反应的离子方程式为__________ 。
(5)25.6g铜与含有1.4molE的浓溶液恰好完全反应,最终得到气体的体积为(标准状况下)__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3 物质结构与性质】
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)Z2+基态核外电子排布式为: 。
(2)YX4-的空间构型是:__________;与YX4-互为等电子体的一种分子为__________(填化学式);HYX4酸性比HYX2强,其原因是:__________________________。
(3)结构简式为RX(WH2)2的化合物中R原子的杂化轨道类型为: ;1molRX(WH2)2分子中含有σ键数目为:_______________。(H为氢元素,下同)
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是:__________。
A.[Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,WH3提供空轨道
C.[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如右图所示(黑点代表Z原子)。

①该晶体的化学式为: 。
②已知Z和Y的电负性分别为1.9和3.0,则Y与Z形成的化合物属于 (填“离子”、“共价”)化合物。
③ 已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为: cm(只写计算式)(Z原子位于体对角线上)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的原子形成的离子可表示为abXn-,有关说法错误的是
A. 中子数为a-b B. 电子数为b+n
C. 质量数为a+b D. 一个离子的质量约为 a/6.02×1023g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4g NaOH固体配成250mL溶液,则Na+的物质的量浓度(mol/L)为
A. 0.0004 B. 0.016 C. 0.4 D. 16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某硫酸和硫酸铜的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法正确的是

A. a点溶液中含有两种溶质
B. bc段发生反应的类型为置换反应
C. 根据图中数据可计算出氢氧化钠溶液的浓度
D. d点浓液中主要存在的离子为Na+、Cu2+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒被誉为“合金的维生素”,常用于催化剂和新型电池。钒(V)在溶液中主要以VO43-(黄色)、VO2+(浅黄色)、VO2+(蓝色)、V3+(绿色)、V2+(紫色)等形式存在。回答下列问题:
(1)工业中利用V2O5制备金属钒。
4Al(s)+3O2(g)=2Al2O3(s) △H1=-2834kJ/mol
4V(s)+5O2(g)=2V2O5(s) △H2=-3109kJ/mol
写出V2O5与A1反应制备金属钒的热化学方程式____________________。
(2)V2O5是一种重要的氧化物,具有以下性质:
①V2O5在强碱性溶液中以VO43-形式存在,试写出V2O5溶于NaOH溶液的离子方程式:___________________________________________。
②V2O5具有强氧化性,溶于浓盐酸可以得到蓝色溶液,试写出V2O5与浓盐酸反应的化学反应方程式:________________________________。

(3)VO43-和V2O74-在PH≥13的溶液中可相互转化。室温下,1.0 mol·L-1的Na3VO4溶液中c(VO43-)随c(H+)的变化如图所示。
①写出溶液中Na3VO4转化为Na4V2O7的离子方程式__________________。
②由图可知,溶液中c(H+)增大,VO43-的平衡转化率______(填“增大”“减小”或“不变”)。根据A点数据,计算该转化反应的平衡常数的数值为_____________。
(4)全钒液流电池是一种优良的新型蓄电储能设备,其工作原理如图所示:

①放电过程中A电极的反应式为__________________。
②充电过程中,B电极附近溶液颜色变化为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程正确的是( )
A.饱和石灰水中通入过量二氧化碳:OH- + CO2 = HCO3-
B.向稀硫酸中投入铁粉:2Fe +6H+ = 2Fe3+ +3H2 ↑
C.实验室制取二氧化碳:CO32- + 2H+ = H2O +CO2 ↑
D.氢氧化钡溶液中加入硫酸:H+ + OH- =H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com