
【题目】某元素的原子形成的离子可表示为abXn-,有关说法错误的是
A. 中子数为a-b B. 电子数为b+n
C. 质量数为a+b D. 一个离子的质量约为 a/6.02×1023g
科目:高中化学 来源: 题型:
【题目】工业上“固定”和利用CO2能有效地减轻“温室效应”。
I.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol,某科学实验将6molCO2和8 molH2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标):
CH3OH(g)+H2O(g) △H=-49.0kJ/mol,某科学实验将6molCO2和8 molH2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标):

回答下列问题:
(1)该反应在______条件下能自发进行(城编号)。
A.高温 B.低温 C.任何温度
(2)该反应在0 ~8 min内CO2的平均反应速率是_______。
(3)该反应的平街常数K=______________。
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,虚线I改变的条件可能是_________。若实线对应条件下平衡常教为K,虚线I对应条件下平衡常数为K1,盛线II对应条件下平衡常数为K2,则K、K1和K2的大小关系是______。
II.己知25℃时,乙酸和碳酸的电离平衡常数如下表:

(1)用饱和氨水吸收CO2可得到NH4HCO3溶液,若已知CH3COONH4溶液pH=7,则NH4HCO3溶液显_____(填“酸性”、“碱性”或“中性”)。
(2)25℃时,在0 . lmol/L乙酸溶液中加入一定量的NaHCO3,保持温度不变,所得混合液的
pH=6,那么混合液中 =_______;该混合溶液中的离子浓度由大到小的顺序为:________________。
=_______;该混合溶液中的离子浓度由大到小的顺序为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在20.00 mL 0.10 mol·L-1CH3COOH溶液中滴入0.10 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积关系如图所示。下列说法正确的是

A. T℃时,CH3COOH电离平衡常数Ka=1.0×10-3
B. M点对应的NaOH溶液体积为20.0 mL
C. N点与Q点所示溶液中水的电离程度:N>Q
D. N点所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对化学反应限度的叙述不正确的是
①任何可逆反应都有一定的限度;
②化学反应的限度是不可改变的;
③化学反应的限度与时间的长短无关;
④化学反应达到限度时,正逆反应的速率相等;
⑤达到平衡时,反应停止了,正、逆反应速率都为零。
A. ①④ B. ②⑤ C. ②③ D. ⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验证明,聚沉能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,聚沉能力越大。
①向Fe(OH)3胶体中加入下列电解质时,其聚沉能力最强的为________(填序号)。
A.NaCl B.FeCl3 C.K2SO4 D.Na3PO4
②为了把黏土溶胶(黏土胶体粒子带负电荷)变成较洁净的水,加入下列电解质时,_______(填序号)效果最明显,原因是_____________________________________________。
A.BaCl2 B.Al2(SO4)3 C.KCl D.CuSO4
(2)已知半透膜有非常细小的孔,只允许较小的离子、分子通过,胶体粒子不能透过。(提示:碘遇淀粉显蓝色)
把10 mL淀粉胶体和5 mL KCl溶液的混合液体加入到用半透膜制成的袋内,将此袋浸入盛蒸馏水的烧杯中,2 min后,用两支试管各取5 mL烧杯中的液体,并做如下实验:
①向其中一支试管里滴加少量AgNO3溶液,其现象是______________________。
②向另一支试管里滴加少量碘水,其现象是__________________________。
③由上述实验得出的结论是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家们合成了如下图所示的一系列的星烷,如三星烷、四星烷、五星烷等。下列说法正确的是

A. 它们之间互为同系物
B. n星烷的化学式为C3nH4n(n为大于等于3的自然数)
C. 四星烷与![]() 互为同分异构体
互为同分异构体
D. 它们的一氯代物均只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向纯水中通入Cl2至饱和,再逐滴滴加0.1mol/L的NaOH溶液,实验过程中得到如下图所示的pH变化曲线。下列有关说法正确的是
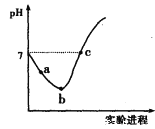
A. pH=7时,一定有c(Na+)=c(Cl-)+c(ClO-)
B. 从a点到b点,Cl2在水中的溶解度增大
C. b点溶液中:c(H+)=c(Cl-)+c(OH-)+c(HClO)
D. 从b点到c点,溶液中![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的单质及其化合物的用途非常广泛.回答下列问题:
(1)基态锰原子的核外电子排布式为_______,其d轨道中未成对电子数为__________.
(2)MnO的熔点(1650℃)比MnS的熔点(1610℃)高,它们都属于___晶体。前者熔点较高的原因是_____________。
(3)锰的一种配合物的化学式为Mn(BH4)2(THF)3,THF的结构简式如图所示。

① 与Mn2+形成配位键的原子为_______(填元素符号)。
② BH4-的空间构型为_______,其中B原子的杂化轨道类型为________。
③ 写出两种与BH4-互为等电子体的分子或离子:___________。
(4)一种磁性材料的单晶胞结构如图所示。

① 该晶胞中碳原子的原子坐标为________。
② Mn在晶体中的堆积方式为________(填“简单立方”“体心立方”“面心立方最密”或“六方最密") 堆积。
③ 若该晶胞的边长为a pm,NA表示阿伏加德罗常数的数值,则该晶体密度的表达式为ρ=_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com