
 铁及铁化合物在生产、生活中有着重要的用途.
铁及铁化合物在生产、生活中有着重要的用途.
| ||
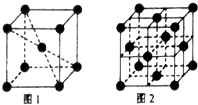
| 4 |
| 晶胞所含原子体积 |
| 晶胞体积 |
2×
| ||
| a3 |
| ||
| 4 |
| 晶胞所含原子体积 |
| 晶胞体积 |
4×
| ||
| a3 |
| ||
| 4 |
| 晶胞所含原子体积 |
| 晶胞体积 |
2×
| ||
| a3 |
| ||
| 4 |
| 晶胞所含原子体积 |
| 晶胞体积 |
4×
| ||
| a3 |


科目:高中化学 来源: 题型:
| A、胶体是一种分散质直径小于10-10m的分散系 |
| B、胶体一定是液态的 |
| C、用一束光线照射胶体,在垂直于光线的方向可看到一条光亮的通路 |
| D、蛋白质溶液不是一种胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某小组通过对人呼吸中各种气体体积分数的实验探究,得到下表所示数据:
某小组通过对人呼吸中各种气体体积分数的实验探究,得到下表所示数据:| X | Y | 二氧化碳 | 水 | 其他 | |
| 呼入气体 | 78% | 21% | 0.03% | 0.06% | 0.91% |
| 呼出气体 | 75% | 15% | 3.68% | 5.44% | 0.88% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9.0L | B、18.5L |
| C、25.7L | D、36.8L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com