

分析 (1)图象分析可知随反应进行锰离子浓度增大,对氧化还原反应起到催化剂的作用;
(2)①已知KHC2O4溶液的pH<7,说明HC2O4-离子在水溶液中电离程度大于水解程度:
②①NH4HC2O4 中铵根离子水解促进HC2O4-离子水解;
②KHC2O4 溶液中HC2O4-离子在水溶液中电离程度大于水解程度;
③H2C2O4 溶液中分步水解,第二步电离出C2O42-离子;
④Na2C2O4,溶液中电离出C2O42-水解;
(3)①向CaSO4混浊液中加入0.1mol•L-1的Na2C2O4,CaC2O4 溶度积常数大于CaSO4实现沉淀转化;
②溶液中存在电荷守恒和物料守恒,计算分析离子浓度大小;
解答 解:(1)草酸根可被酸性KMnO4溶液氧化:2MnO4-+5C2O42-+16H+=2Mn2+10CO2↑+8H2O,实验测得,60秒后c(MnO4-)迅速减小的原因可能是随反应进行锰离子浓度增大,对氧化还原反应起到催化剂的作用,故答案为:反应生成的锰离子对反应起到催化剂的作用;
(2)①已知KHC2O4溶液的pH<7,说明HC2O4-离子在水溶液中电离程度大于水解程度,溶液中c(C2O42-)>c(H2C2O4),故答案为:>:
②①NH4HC2O4 中铵根离子水解促进HC2O4-离子水解,C2O42-离子浓度减小;
②KHC2O4 溶液中HC2O4-离子在水溶液中电离程度大于水解程度;
③H2C2O4 溶液中分步水解,第二步电离出C2O42-离子,C2O42-离子浓度最小;
④Na2C2O4,溶液中电离出C2O42-水解,溶液中C2O42-离子浓度最大,
溶液中C2O42-离子浓度由大到小的顺序为④②①③,故答案为:④②①③;
(3)①已知20℃时,Ksp(CaC2O4)=2.5×10-9、Ksp(CaSO4)=2.0×10-4,向CaSO4混浊液中加入0.1mol•L-1的Na2C2O4,CaC2O4 溶度积常数大于CaSO4实现沉淀转化,反应的离子方程式为:CaSO4(s)+C2O42-?CaC2O4(s)+SO42-,
故答案为:CaSO4(s)+C2O42-?CaC2O4(s)+SO42-;
②溶液中存在电荷守恒c(Na+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-),物料守恒c(Na+)=2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4),计算得到:c(Cl-)=2c(H2C2O4)+c(HC2O4-),溶液中c(Cl-)>c(HC2O4-+c(H2C2O4),
故答案为:>;
点评 本题考查了盐类水解、电解质溶液中离子浓度大小比较、电荷守恒、物料守恒计算应用、水解平衡和电离平衡影响因素、沉淀转化等知识点,掌握基础是解题关键,题目难度中等.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:选择题
| A. | 10gH2 和10gO2 | B. | 5.6LN2(标准状况)和11gCO2 | ||
| C. | 9gH2O和0.75molBr2 | D. | 224mL H2(标准状况)和0.1molN2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将58.5 g NaCl溶于1 L 水中可得1 mol•L-1的NaCl溶液 | |
| B. | 将标准状况下22.4 L HCl溶于1 L 水中可得1 mol•L-1盐酸 | |
| C. | 将25.0 g胆矾溶于水后配成100 mL溶液所得溶液中溶质的物质的量浓度为1 mol•L-1 | |
| D. | 将78 g Na2O2溶于水,配成1 L溶液,其物质的量浓度为1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2$\stackrel{点燃}{→}$ CO2+2H2O | B. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | ||
| C. | CH4$\stackrel{高温}{→}$ C+2H2 | D. | 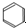 +HO-NO2$→_{△}^{浓硫酸}$H2O+ +HO-NO2$→_{△}^{浓硫酸}$H2O+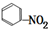 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4 | B. | KAl(SO4)2 | C. | NaHCO3 | D. | CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
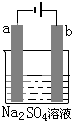 图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )
图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )| A. | a电极的产物有Cu和H2 | |
| B. | 反应一段时间后,溶液的pH值变小 | |
| C. | a电极附近呈红色,b电极附近出现蓝色. | |
| D. | a、b电极转移的电子数为0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
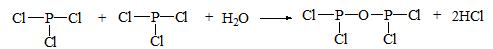
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com