
【题目】设NA为阿伏加德罗常数值,下列有关叙述正确的是
A. 将78gNa2O2与过量CO2反应转移的电子数为2NA
B. 1mol N2与 4mol H2反应生成的NH3分子数为2NA
C. 标准状况下,2.24L SO3中所含原子数为0.4 NA
D. 标准状况下,18g D2O中所含电子数为9 NA
科目:高中化学 来源: 题型:
【题目】25℃时,相同物质的量浓度的下列溶液:①NaCl;②NaOH;③H2SO4;④(NH4)2SO4,其中水的电离程度按由大到小顺序排列的一组是( )
A.④>③>②>① B.②>③>①>④ C.③>②>①>④ D.④>①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在KNO3、MgSO4、K2SO4组成的混合溶液中Mg2+0.5 mol、NO3-0.2 mol、SO42- 0.6 mol,则溶液中K+的物质的量为( )
A.0.4 mol B.0.3 mol C.0.2 mol D.0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO4在水溶液中能够电离出H+、Na+和SO42-。下列对于NaHSO4的分类中不正确的是
A. 硫酸盐 B. 酸式盐 C. 钠盐 D. 酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的说法不正确的是( )
A.第15列某元素能形成碱性气体
B.第2列元素中肯定没有非金属元素
C.第17列的第一种元素的原子序数为8
D.短周期中能与强碱反应产生H2的金属元素位于第ⅢA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列有关叙述正确的是
A.120gNaHSO4和MgSO4固体中含有SO42-的数目为NA
B.常温下,1LpH=12的氨水中含有的OH-数目为0.01NA
C.60g乙酸中存在的共有电子对数为7NA
D.1L0.1mol/L氢氟酸中c(H+)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇即是重要的化工原料,又是新型汽车动力燃料。已知甲醇常温下为液态,其燃烧△H=-726.5KJ/mol。
(1)写出表示甲醇燃烧热的热化学方程式: 。
(2)甲醇脱氢制取甲醛的原理为CH3OH(g) ![]() HCHO(g)+H2(g),某科研小组在1L密闭容器中充入1molCH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示,回答下列问题:
HCHO(g)+H2(g),某科研小组在1L密闭容器中充入1molCH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示,回答下列问题:
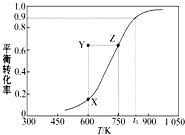
①由图可知,该反应的△H 0(填“>”、“<”、“=”)。
②下列选项中,能说明该反应达到平衡状态的是 。
A.v(CH3OH)=v(HCHO)
B.H2浓度不再变化
C.混合气体平均相对分子质量不再变化
D.混合气体密度不变
③在t1K时,该反应的平衡常数为K ,此温度下,从反应开始到平衡所经过的时间为10s,则v(HCHO)为 mol/(L·s),向此容器中再通入1.1molCH3OH和1.1molH2,则平衡向 移动(填“向左”、“向右”、“不”)
④600K时,Y点甲醇的v(正) v(逆) (填“>”、“<”、“=”),理由是 。
(3)某甲醇燃料电池(简称DMFC),该电池由于结构简单,能量转化率高,对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:
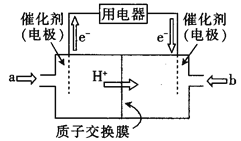
①负极的电极反应式为 。
②若质子交换膜左右两侧的溶液均为1L2mol/LH2SO4溶液,当电池中有1mol电子转移时,左右两侧溶液的质量之差为 g(忽略气体的溶解,假设反应完全耗尽)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com