
【题目】甲醇即是重要的化工原料,又是新型汽车动力燃料。已知甲醇常温下为液态,其燃烧△H=-726.5KJ/mol。
(1)写出表示甲醇燃烧热的热化学方程式: 。
(2)甲醇脱氢制取甲醛的原理为CH3OH(g) ![]() HCHO(g)+H2(g),某科研小组在1L密闭容器中充入1molCH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示,回答下列问题:
HCHO(g)+H2(g),某科研小组在1L密闭容器中充入1molCH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示,回答下列问题:
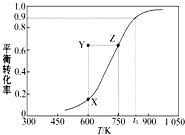
①由图可知,该反应的△H 0(填“>”、“<”、“=”)。
②下列选项中,能说明该反应达到平衡状态的是 。
A.v(CH3OH)=v(HCHO)
B.H2浓度不再变化
C.混合气体平均相对分子质量不再变化
D.混合气体密度不变
③在t1K时,该反应的平衡常数为K ,此温度下,从反应开始到平衡所经过的时间为10s,则v(HCHO)为 mol/(L·s),向此容器中再通入1.1molCH3OH和1.1molH2,则平衡向 移动(填“向左”、“向右”、“不”)
④600K时,Y点甲醇的v(正) v(逆) (填“>”、“<”、“=”),理由是 。
(3)某甲醇燃料电池(简称DMFC),该电池由于结构简单,能量转化率高,对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:
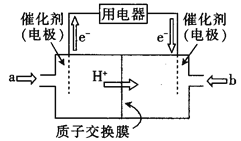
①负极的电极反应式为 。
②若质子交换膜左右两侧的溶液均为1L2mol/LH2SO4溶液,当电池中有1mol电子转移时,左右两侧溶液的质量之差为 g(忽略气体的溶解,假设反应完全耗尽)
【答案】
(1)CH3OH(I)+3/2O2(g)=CO2(g)+2H2O(I) △H=-726.5kJ·mol-1
(2)①>;②bc;③8.1;0.09;向右;④<;Y点甲醇的转化率大于X点,反应应向逆反应方向进行;
(3)①CH3OH-6e-+H2O=CO2+6H+;②12;
【解析】
试题分析: (1)根据题意,甲醇燃烧热的热化学方程式为CH3OH(I)+3/2O2(g)=CO2(g)+2H2O(I) △H=-726.5kJ·mol-1,故答案为:CH3OH(I)+3/2O2(g)=CO2(g)+2H2O(I) △H=-726.5kJ·mol-1;
(2)①由图可知,温度越高,平衡时甲醇的转化率越大,说明升高温度平衡向正反应方向移动,则正反应为吸热反应,则△H>0,故答案为:>;
②a.没有指明正、逆速率,若均为正反应反应速率,二者反应速率始终相等,故a错误;b.随反应进行氢气的浓度增大,当H2的浓度不再变化时,说明到达平衡,故b正确;c.混合气体的总质量不变,随反应进行总物质的量增大,故随反应进行平均相对分子质量减小,当平均相对分子质量不再变化时,说明到达平衡,故c正确;d.混合气体总质量不变,容器体积不变,混合气体的密度始终不变,不能说明到达平衡,故d错误,故答案为:bc;
③由图可知,T1K时甲醇的转化率为0.9,则参加反应甲醇的物质的量为0.9mol,容器体积为1L,则甲醇的起始浓度为1mol/L,浓度变化量为0.9mol/L,则:
CH3OH(g) ![]() HCHO(g)+H2(g)
HCHO(g)+H2(g)
开始(mol):1 0 0
转化(mol):0.9 0.9 0.9
平衡(mol):0.1 0.9 0.9
故T1K时,平衡常数K=![]() =
=![]() =8.1,此温度下,从反应开始到平衡所经过的时间为10s,则v(HCHO)=
=8.1,此温度下,从反应开始到平衡所经过的时间为10s,则v(HCHO)=![]() =0.09mol/(L.s),达到平衡后若再向此容器中再通入1.1molCH3OH和1.1molH2,此时的浓度商Qc=
=0.09mol/(L.s),达到平衡后若再向此容器中再通入1.1molCH3OH和1.1molH2,此时的浓度商Qc=![]() =1.5<K=8.1,平衡向正反应方向进行,故答案为:8.1;0.09;正反应方向;Qc=
=1.5<K=8.1,平衡向正反应方向进行,故答案为:8.1;0.09;正反应方向;Qc=![]() =1.5<K=8.1;
=1.5<K=8.1;
④由图可知,Y点的转化率高于相同温度下平衡点X的转化率,故Y点反应向逆反应方向移动,则v(正)<v(逆),故答案为:<;Y点的转化率高于相同温度下平衡点X的转化率,故Y点反应向逆反应方向移动;
(3) ①根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,故答案为:CH3OH-6e-+H2O=CO2+6H+;
②负极反应式为 2CH3OH-12e-+2H2O=2CO2+12H+,正极反应式为3O2+12e-+12H+=6H2O,当电池中有12mol电子转移时,负极生成的12mol电子移向正极,负极溶液质量36g水,正极通入的3mol氧气与负极转移过来的12mol电子生成6mol水,质量增加108g,左右两侧溶液的质量之差为144g,因此当电池中有1mol电子转移时,左右两侧溶液的质量之差为12g,故答案为:12。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列描述中,不符合生产实际的是( )
A. 在镀件上电镀锌,用锌作阳极
B. 电解法精炼粗铜,用纯铜作阴极
C. 电解饱和食盐水制烧,用涂镍碳钢网作阴极
D. 电解熔融的氧化铝制取金属铝,用铁作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列有关叙述正确的是
A. 将78gNa2O2与过量CO2反应转移的电子数为2NA
B. 1mol N2与 4mol H2反应生成的NH3分子数为2NA
C. 标准状况下,2.24L SO3中所含原子数为0.4 NA
D. 标准状况下,18g D2O中所含电子数为9 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的使用合理的是
A.碳酸钠用于治疗胃酸过多
B.婴儿食品应添加着色剂,以增加婴儿对食物的兴趣
C.维生素C可防治坏血病,因而我们需要大量补充维生素C
D.药物可以帮助我们战胜疾病,但我们仍需合理用药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在城市地下常埋有纵横交错的管道和运输电线路,有些地面上还铺有地铁或城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道或铁轨形成回路时,就会引起金属管道、铁轨的腐蚀。原理简化如图所示。则下列有关说法不正确的是
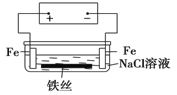
A.原理图可理解为两个串联电解装置
B.如在NaCl溶液中加入酚酞,右边Fe电极附件溶液变红
C.地下管线被腐蚀,不易发现,也不便维修,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等)
D.溶液中铁丝左端电极反应式为:Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿佛加德罗常数,下列说法正确的是( )
A.标准状况下,2.24L水的质量为1.8g
B.常温常压下,32gO3含有的原子数为2NA
C.11.2L的N2含有的质子数为7NA
D.0.1molNa投入到5mL水中转移电子数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把4 mol A气体和4 mol B气体混合放入2 L的恒容密闭容器中,在一定条件下发生反应:2A(g)+2B(g) ![]() C(g)+2D(g);经5min达到平衡, 测得压强减小了10%,下列说法中正确的是
C(g)+2D(g);经5min达到平衡, 测得压强减小了10%,下列说法中正确的是
A.平衡体系中C的体积分数为1/9
B.平衡时A的浓度为2.4mol/L
C.D的平均速率为0.32mol/(L·min)
D.B的转化率为20%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com