
(10分)已知 2 mol SO2 (g) 氧化为2 mol SO3 (g) 的能量变化如图所示:
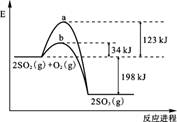
(1)写出SO2 (g) 氧化为SO3 (g) 的热化学方程式:
(2)氧化SO2时,工业上常加入V2O5作催化剂,其反应机理可表示为
SO2 + V2O5 = SO3 + 2VO2 , 4VO2 + O2 = 2V2O5 ;
上图中表示加入V2O5的反应曲线为 (填“a”或“b”)。
(3)若在容积为2 L的密闭容器中充入2 mol SO2 (g)和1 mol O2 (g),如图甲所示,经2 min达到平衡,测得放出热量为178.2 kJ,则:

①2 min内 O2的化学反应速率v(O2)= ;
②若再充入1 mol O2重新达到平衡时,SO3平衡浓度的取值范围是: 。
(4)若将2 mol SO2 (g)和1 mol O2 (g)充入容积可变的容器乙中,初始体积为2 L,达到平衡时放出热量Q kJ,则Q 178.2 kJ(填“>”,“=”或“<”)。
(1)2SO2(g) + O2(g)  2SO3(g),ΔH=-198 kJ/mol (2)b
2SO3(g),ΔH=-198 kJ/mol (2)b
(3)① 0.225 mol·L-1·min-1 ② 0.9mol/L<c(SO3)<1 mol/L (4)>
【解析】(1)根据图像可知,反应是放热反应,所以热化学方程式为2SO2(g)
+ O2(g)  2SO3(g),ΔH=-198 kJ/mol。
2SO3(g),ΔH=-198 kJ/mol。
(2)催化剂能降低反应的活化能,但不能改变反应热,所以答案是b。
(3)①放出热量为178.2 kJ,则消耗的氧气是178.2÷198=0.9mol,所以氧气的反应速率是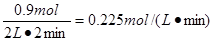 。
。
②在冲入氧气之前生成三氧化硫是1.8mol,但反应是可逆反应,所以无论冲入多少氧气,三氧化硫的物质的量不能超过2mol,所以浓度范围是0.9mol/L<c(SO3)<1 mol/L。
(4)乙是保持恒压的,又因为反应是体积减小的可逆反应,所以乙中反应物的转化率要大于甲中的,即放出的热量大于Q kJ。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤Ⅰ |
| Mg,800℃,Ar |
| 步骤II |
| ||
| Ar |
| ||
| Ar |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ?mol-1表示.请认真观察图,然后回答问题.| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
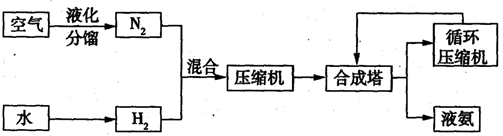
| 气体名称 | 氨气 | 氧气 | 氦气 | 氖气 | 氩气 | 氪气 | 氚气 |
| 沸点/℃ | -196 | -183 | -269 | -264 | -186 | -153 | -108 |
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J?t-1 | 28×109 | 38×109 | 48×109 |
| ||
| 高温 |
| ||
| 高温 |
| NH3含量% 压强/MPa 温度/℃ |
0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
 2NH3的△H
2NH3的△H| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com