
����Ŀ���Ӻ�ˮ�п���ȡ���ֻ�����Ʒ����ͼ�ǹ�ҵ�϶Ժ�ˮ��һ���ۺ����õ�����ͼ��
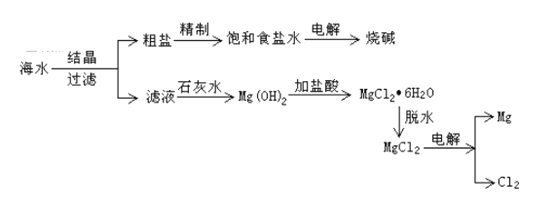
��1������ʱ����Ҫ��������Ϊ�ձ���©����_________������IJ��������ڹ���ʱ������______________�����á�
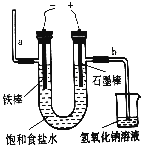
��2����ͼΪ���ʳ��ˮ��װ�ã�ʯī�缫�ϲ���������Ϊ_________����������Χ����Һ��μӷ�̪��Һ����Һ��________ɫ��
��3��д����ⱥ��ʳ��ˮ�Ļ�ѧ����ʽ��____________________________��
��4���±���ij���ӵ�ʳ������װ���ϵIJ�������˵��.
���� | �Ȼ���(NaCl)�������(KIO3) |
������ | 20��40 mg��kg��1 |
������ | 18���� |
ʳ�÷��� | ��ʱ������ |
����ָ�� | ���ȡ��ܹ⡢�ܷ⡢���� |
�پ��ⶨ�������ӵ�ʳ������KIO3�ĺ���Ϊ42.8 mg��kg��1������ÿǧ�����ӵ�ʳ������KIO3�����ʵ���Ϊ__mol�������ӵ�ʳ�����ĺ�����Ϊ__mg��kg��1��
�ڽ�5.0 g�����ӵ�ʳ��������ˮ�����100 mL��Һ������Һ��IO3���������ʵ���Ũ��Ϊ___________mol��L��1��
���𰸡� ������ ���� ��������Cl2�� �� 2NaCl+2H2O![]() C12��+ H2��+2NaOH 0.0002 25.4 1��10��5
C12��+ H2��+2NaOH 0.0002 25.4 1��10��5
����������1��ʵ���ҶԺ�ˮ���й���ʱ������Ҫ��������Ϊ�ձ���©���Ͳ��������������ڹ��˲����������������ã���2����ⱥ��ʳ��ˮ�����Դ����������FeΪ�������������Դ�������ӵĵ缫ʯīΪ������������Һ��������������ʧ���ӷ���������Ӧ����������ʯī�缫�ϲ���������Ϊ��������Һ���������������õ����ӷ�����ԭ��Ӧ�����������缫����ˮ�ĵ���ƽ�ⱻ�ƻ�������������Ũ��������Һ�Լ��ԣ���������Χ����Һ��μӷ�̪����Һ���ɫ����3����ⱥ��ʳ��ˮ�Ļ�ѧ����ʽΪ2NaCl+2H2O![]() C12��+H2��+2NaOH����4����n=m/M=0.0428g��214g/mol=0.0002mol����˸����ӵ�ʳ�����ĺ�����Ϊ0.0002��127��1000��25.4mg��kg��1����5.0g�����е���ص����ʵ�����5g/1000g��0.0002mol=0.000001mol��������Һ��IO3-�������ʵ���Ũ��Ϊ0.000001mol��0.1L=0.00001mol/L��
C12��+H2��+2NaOH����4����n=m/M=0.0428g��214g/mol=0.0002mol����˸����ӵ�ʳ�����ĺ�����Ϊ0.0002��127��1000��25.4mg��kg��1����5.0g�����е���ص����ʵ�����5g/1000g��0.0002mol=0.000001mol��������Һ��IO3-�������ʵ���Ũ��Ϊ0.000001mol��0.1L=0.00001mol/L��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ�����ӷ�Ӧ�Ǹ�һ��ѧ������Ҫ��ѧ��Ӧ��������ϸ˼���ش�����������
����������һ����ˮ����ķ�Ӧ��
��2Na + 2H2O = 2NaOH + H2�� ��2Na2O2 + 2H2O = 4NaOH + O2��
��Na2O + H2O =2NaOH ��2H2O![]() 2H2��+ O2�� ��2F2 + 2H2O = 4HF + O2
2H2��+ O2�� ��2F2 + 2H2O = 4HF + O2
��1�����в�����������ԭ��Ӧ����____________��������
��2������Щ������ԭ��Ӧ����ˮֻ���������ķ�Ӧ��___________�����ţ���ˮֻ����ԭ
���ķ�Ӧ��___________�����ţ���ˮ����������,������ԭ����_________�����ţ���ˮ�Ȳ������������ֲ�����ԭ����___________�����ţ���
��3�������������,������ԭ��Ӧ��������_____��
A.�����е�ԭ��������� B.��Ԫ�صĵ�ʧ
C.���ӵĵ�ʧ���õ��ӶԵ�ƫ�� D.���ϼ۵ĸı�
��4������������ѧ֪ʶ����3NO2+H2O��2HNO3+NO�Ƿ�����������ԭ��Ӧ��______�����������������������������������Ӧ����������_________������������________���������ĵ�Ԫ���뱻��ԭ�ĵ�Ԫ�ص����ʵ���֮����______�����3mol��NO2��ȫ��Ӧ��Ӧת��____________��������
�����������������ʣ�������ţ�
�� ͭ �� CO2 �� ˮ �� CaCO3���� �� ����
�����������ܵ������______________���������������ڵ���ʵ���____________���������������ڷǵ���ʵ�________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����λ�����Ⱦ��������̬�����ѳ�Ϊȫ��ʶ��
�����и�ͼ�б�ʾ�ҹ����ܱ�־����������ĸ����
��ú����ʱ�ᷢ����˹��ը�¹ʣ���˹����Ҫ�ɷ�����Ȼ����ͬ��д����˹��ը�Ļ�ѧ����ʽ�� ��
�ۻ�����Ⱦ�Ѷ���������ش���в�����������뻷����Ⱦ�ص���
A����ϫB������ЧӦC��������ն�D����ҵ��ˮ
�ܼ������ڿ�����Ⱦ�����д�ʩ��ȷ����
A����������ֲ«���������ٵ���ɫֲ��
B�����������װ�Σ�װ�β��Ͽ���������
C�������Ŵ�
D����������ζʱ��Ҫ��ʱ��������ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ѱ�ҵ�ĸ���ƷFeSO4[��Al2��SO4��3�������ؽ�������]������������ؼ��ߴ���ϸ�����������乤��������ͼ1�� 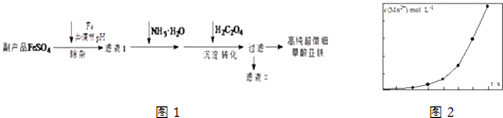
��֪����5Fe2++MnO ![]() +8H+�T5Fe3++Mn2++4H2O
+8H+�T5Fe3++Mn2++4H2O
��5C2O42��+2MnO ![]() +16H+�T10CO2��+2Mn2++8H2O
+16H+�T10CO2��+2Mn2++8H2O
��1���������̵ķ�Ӧ�¶�Ϊ40�棬�¶Ȳ��˹��ߵ�ԭ����˿��Ƴ����������⣬����
��2����Һ�����ɵõ�����Ʒ ��
��3��ʵ���Ҳⶨ�ߴ���ϸ����������ɵIJ�������Ϊ��
����1��ȷ����һ��������������Ʒ������25mL 2molL��1��H2SO4�ܽ⣮
����2����0.2000molL��1��KMnO4��Һ�ζ������������30.40mL��
����3����ζ������Һ�м���2g Zn�ۺ�5mL 2molL��1��H2SO4��Һ����Fe3+��ԭΪFe2+ ��
����4�����ˣ���Һ��������KMnO4��Һ�ζ���������Һ10.40mL��
����Ʒ��C2O42�������ʵ���Ϊ ��
��4����һ�������������Һ���ữ�IJ���������Һ��ϣ���÷�ӦҺ��Mn2+��Ũ���淴Ӧʱ��t�ı仯��ͼ2���������ֱ仯���Ƶ�ԭ�����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.�����£�pH=3��pH=5�������10mL��ϣ�������Һ��pH=4
B.���¶Ȳ���ʱ���ڴ�ˮ�м���ǿ����Һ����Ӱ��ˮ�����ӻ�����
C.Һ����Ȼ�����磬���ܽ���ˮ��������ã���ˣ�Һ��Ҳ��ǿ�����
D.��Һ��c��H+��Խ��pHҲԽ����Һ�����Ծ�Խǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤Cl2��Br2��������ǿ�������������ʵ�飺���ɹ�ѡ����Լ��У���ˮ����ˮ��NaCl��Һ��NaBr��Һ���ƾ������Ȼ�̼��ʵ�鲽����ͼ����дͼ�еĿհף� 
��1��2mL �Լ������������Լ����ټ��� �Լ��� ���� ��
��2������֤��Cl2�����������ǿ�ڡ������ڡ���Br2�������ԣ���Ԫ�صķǽ��������ǿ�ڡ������ڡ�����Ԫ�صķǽ����ԣ�
��3���˷�Ӧ�����ӷ���ʽΪ�� ��
��4��ij��Һ��Cl����Br����I�������ʵ���֮��Ϊ4��1��4��Ҫʹ��Һ�е�Cl����Br����I�������ʵ���֮�ȱ�Ϊ7��1��1����ͨ��Cl2�����ʵ�����ԭ��Һ��I�������ʵ���֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʹH2OH++OH������ƽ��������Ӧ�����ƶ�������������Һ�����Ե��ǣ� ��
A.��ˮ���ȵ�99�棬ʹˮ��pH=6.1
B.��ˮ�е���ϡH2SO4
C.��ˮ�м���Na2CO3����
D.��ˮ�м����Ȼ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��2����ѧ�뼼���� п�̵�أ��׳Ƹɵ�أ��������е������ܴ�����п�̵�صĹ�����ͼ��a����ʾ���ش��������⣺
��1����ͨп�̵�طŵ�ʱ��������Ҫ��ӦΪ��Zn+2NH4Cl+2MnO2�TZn��NH3��2Cl2+2MnOOH �ٸõ���У�����������Ҫ�� �� ����ʵ���Ҫ�ɷ��� �� ������������Ҫ��Ӧ�� ��
������ͨп�̵����ȣ�����п�̵�ص��ŵ㼰�������� ��
��2��ͼ��b����ʾ�������÷Ͼ���ͨп�̵�ع��գ������ǷϾɵ����ʵ�ʴ��ڵ����������������� 
��ͼ��b���в���Ļ�ѧʽ�ֱ�ΪA �� B ��
�ڲ���a�еõ��ۿ����Ҫ�ɷ���K2MnO4 �� ����b�У���ɫ��K2MnO4��Һ��Ӧ������ɫ��Һ��һ�ֺں�ɫ���壬�÷�Ӧ�����ӷ���ʽΪ ��
�۲��ö��Ե缫���K2MnO4��ҺҲ�ܵõ�������D�����������õ�����Ҫ���������ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20 mL1 mol��L��1 AlCl3��Һ�е���1 mol��L��1NaOH��Һʱ���������ʵ�����mol�������μ�NaOH��Һ���(mL)��ϵ��ͼ��ʾ��

(1)ͼ��A���ʾ��������__________________________��B��C����ֵ��Ϊ__________��
(2)ͼ��OA�η�����Ӧ�Ļ�ѧ����ʽ�ɱ�ʾΪ��________________________________��AC�η�����Ӧ�Ļ�ѧ����ʽ�ɱ�ʾΪ��_________________________________________����C���Ӧ��Һ��ͨ�����CO2������Ӧ�����ӷ���ʽΪ��_________________________��
(3)A���Ӧ�ij��������ʵ���Ϊ_________mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com