
分析 (1)过氧化氢是弱电解质属于二元弱酸分部电离;
(2)根据水的自偶电离可知,H2O2自偶电离生成H3O2+和HO2-.
解答 解:(1)过氧化氢是弱电解质,H2O2溶液显酸性属于二元弱酸分部电离,电离的方程式为:H2O2?H++HO2-、HO2-?H++O22-,
故答案为:H2O2?H++HO2-、HO2-?H++O22-;
(2)水电离生成H3O+和OH-叫做水的自偶电离,同水一样,H2O2也有极微弱的自偶电离,其自偶电离的方程式:H2O2+H2O2?H3O2++HO2-,
故答案为:H2O2+H2O2?H3O2++HO2-.
点评 本题考查了弱电解质的电离方程式的书写,题目较简单,注意多元弱酸分步电离,侧重于考查学生的分析能力和对基础知识的应用能力.


科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
下列常用实验仪器中,不能直接用于混合物的分离或提纯的是
A. 分液漏斗 B. 普通漏斗 C. 蒸馏烧瓶 D. 容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其溶液中的c(OH-)=0.1mol•L-1 | |
| B. | 加水稀释后,水电离出的c(OH-)变大 | |
| C. | 加水稀释后,溶液中c(NH4+)•c(OH-)变大 | |
| D. | 与AlCl3溶液发生反应的离子方程式为:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
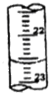 某学生用0.1000mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
某学生用0.1000mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:| 滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 20.38 |
| 第二次 | 20.00 | 4.00 | 24.20 |
| 第三次 | 20.00 | 2.38 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同样多 | B. | HCl最多 | C. | 醋酸最多 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
下列有关阿伏伽德罗定律的说法不正确的是
A.同温同压下,相同质量的NO和C2H4(气体)体积相同
B.同温同压下,气体的密度之比等于摩尔质量之比
C.同 温同压下,相同体积的H2和CO2的原子数之比为2:3
温同压下,相同体积的H2和CO2的原子数之比为2:3
D.同温同体积的气体,若物质的量相同则压强相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com