
【题目】在一定条件下,反应A(g)+B(g)![]() C(g)(正反应为放热反应)达到平衡后,根据下列图像判断:
C(g)(正反应为放热反应)达到平衡后,根据下列图像判断:
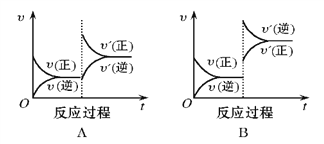
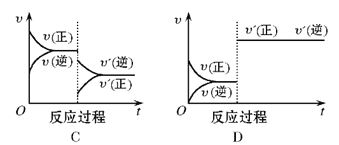

(1)升温,达到新平衡的是_________,新平衡中C的体积分数_________(填增大、减小或不变,下同) 。
(2)降压,达到新平衡的是__________,A的转化率__________。
(3)增加A的量,达到新平衡的是__________,此时B的转化率__________。
(4)使用催化剂,达到平衡的是__________, C的质量分数__________。
【答案】 B 减小 C 减小 A 增大 D 不变
【解析】(1)升高温度应该是正逆反应都加快,平衡向逆反应(吸热)方向移动,所以应该υ正<υ逆,图像B正确。因为平衡向逆反应方向移动,新平衡中C的体积分数将减小。
(2)降低压强应该是正逆反应都减慢,平衡向逆反应(气体物质的量增加)方向移动,所以应该υ正<υ逆,图像C正确。因为平衡向逆反应方向移动,A的转化率将减小。
(3)增加A的量应该是正反应速率瞬间增大,逆反应速率瞬间不变,平衡向正反应方向移动,所以应该υ正大于υ逆,图像A正确。反应物有两个,增加A的量平衡正向移动,B的转化率增大。
(4)使用催化剂能同时同程度加快正逆反应速率,但是平衡不移动,所以图像D正确。平衡不移动,所以C的质量分数不变。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. 二氧化锰具有较强的氧化性,可作H2O2分解的氧化剂
B. 铝能置换出氧化铁中的铁,可用于钢铁工业中大量冶炼铁
C. AlCl3是电解质,可电解熔融AlCl3制铝
D. 油脂能在碱性条件下水解,可用于工业上制取肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列鉴别物质的方法能达到目的的是
A. 用氨水鉴别MgCl2溶液和AlCl3溶液
B. 用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
C. 用KSCN溶液鉴别FeCl3溶液和FeCl2溶液
D. 用淀粉溶液鉴别加碘盐和未加碘盐(己知加碘盐中添加的是KIO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种.下列根据实验事实得出的结论错误的是( )
A.取一定量固体,溶解,向溶液中通入足量的CO2 , 观察到有晶体析出,说明原固体中一定含有 Na2CO3
B.取一定量固体,溶解,向溶液中加人适量CaO粉末,充分反应后观察到有白色沉淀生成,说明 原固体中一定含有Na2CO3
C.取一定量固体,溶解,向溶液中滴加适量AgNO3溶液后有白色沉淀生成,这个现象不能说明原固体中一定含有NaCl
D.称取3.80g固体,加热至恒重,质量减少了 0.620g.用足童稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于配合物[Zn(NH3)4]Cl2的说法正确的是( )
A.配位数为6
B.配体为NH3和Cl﹣
C.[Zn(NH3)4]2+为内界
D.Zn2+和NH3以离子键结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①②③④四种金属片两两相连浸入稀硫酸中都可组成电池,①②相连时,电路电流从②流向①;①③相连时,③为正极,②④相连时,②有气泡逸出现,③④相连时,③的质量减少,据此判断这四种金属活动性由大到小的顺序是
A. ①③②④ B. ①③④② C. ③④②① D. ③①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+ . AgNO2是一种难溶于水、易溶于酸的化合物.试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+ . 若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是(填序号).
A.亚硝酸盐被还原
B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+
D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是(填序号).
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI﹣淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(3)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,请写出反应的离子方式: .
(4)Fe与过量稀硫酸反应可以制取FeSO4 . 若用反应所得的酸性溶液,将Fe2+转化为Fe3+ , 要
求产物纯净,可选用的最佳试剂是(填序号).
a.Cl2 b.Fe c.H2O2 d.HNO3
(5)若FeSO4和O2的化学计量数比为2:1,试配平下列方程式:
FeSO4+K2O2→ K2FeO4+K2O+K2SO4+O2↑
当转移了1.5NA个电子时,在标况下可收集到 L氧气.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于硅及其化合物的叙述中,不正确的是( )
A.硅是良好的半导体材料
B.二氧化硅能与石灰石反应:SiO2+CaCO3 ![]() CaSiO3+CO2↑
CaSiO3+CO2↑
C.可以用焦炭还原二氧化硅生产硅:SiO2+2C ![]() Si+2CO↑
Si+2CO↑
D.水泥的主要成分是 Na2SiO3、CaSiO3 和 SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】综合处理“工业三废”,有利于保护环境,节约资源. 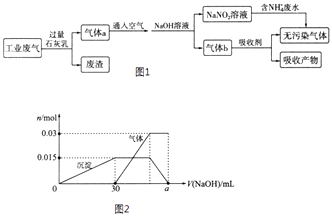
(1)为处理某工厂的工业废气(主要含N2、SO2、NO、CO,不考虑其他成分),设计了如图1流程:
已知:NO+NO2+2NaOH=2NaNO2+H2O;
2NO2+2NaOH=NaNO3+NaNO2+H2O.
①废渣的成分为(填化学式).
②通入空气不能过量,原因是 .
③吸收剂所吸收的气体主要是
④处理含NH4+废水时,发生反应的离子方程式为
(2)某无色工业废水中可能含有NH4+、Na+、Al3+、Cu2+、Cl﹣、SO42﹣、CO32﹣等离子中的几种离子.为确定其成分,设计如下实验:
a.取10mL该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,充分反应后过滤得到0.04mol白色沉淀,向滤液中加入AgNO3溶液无沉淀产生.
b.另取10mL该废水于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后沉淀完全溶解.沉淀和气体的物质的量随加入NaOH溶液体积的变化关系如图2所示.(不考虑沉淀、气体的溶解和损失)
根据上述实验和图表数据:
①该废水中一定含有的离子有(填离子符号).
②实验室配制100mL所需浓度的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要(填仪器名称).
③图中a= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com