
| A. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | 35Cl、37Cl为不同的核素,有不同的化学性质 | |
| C. | 实验室制备Cl2,不宜用排水法收集 | |
| D. | 铁丝在氯气燃烧生成氯化亚铁 |
科目:高中化学 来源: 题型:选择题
| A. | CH3CHO (l) | B. | CH3CHO (g) | C. | CO(g) | D. | CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
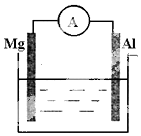 如图所示装置:
如图所示装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧碱、液态氧、碘酒 | B. | 硫磺、白磷、小苏打 | ||
| C. | 干冰、铁、氯化氢 | D. | 空气、氮气、氯水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| B. | 0.1 mol/L NaHCO3溶液:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) | |
| C. | 0.3mol/L和0.1mol/L的两醋酸溶液中H+离子浓度之比为3:1 | |
| D. | 25℃时,浓度均为0.1mol•L-1的CH3COOH和CH3COONa混合溶液的pH=4.75,则c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水 | B. | NaOH固体 | C. | Na2CO3固体 | D. | NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 完成下列问题:
完成下列问题:| 实验编号 | 待测盐酸溶液的体积/mL | 滴入NaOH溶液的体积/mL |
| 1 | 20.00 | 23.00 |
| 2 | 20.00 | 23.10 |
| 3 | 20.00 | 22.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15g甲基(-CH3)所含有的电子数是10 NA个 | |
| B. | 标准状况下,2.24 L CHCl3的原子总数为0.5 NA个 | |
| C. | 4.2g C3H6中含有的碳碳双键数一定为0.1NA | |
| D. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com