
| A. | 金属元素的原子只有还原性,离子只有氧化性 | |
| B. | 金属元素在化合物中一定显正价 | |
| C. | 金属单质都可以和酸反应置换出氢气 | |
| D. | 金属元素的单质在常温下均为固体 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 4HCN(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn(CN)2+(CN)2↑+2H2O | |
| B. | (CN)2+H2O═2H++CN-+CNO- | |
| C. | (CN)2+2OH-═CN-+CNO-+H2O | |
| D. | (CN)2+2SCN-═2CN-+(SCN)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
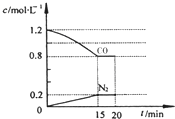 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焰色反应反映出物质的化学性质 | |
| B. | 所有金属及其化合物灼烧时火焰均有颜色 | |
| C. | 焰色反应均应透过蓝色钴玻璃观察 | |
| D. | NaCl与Na2CO3灼烧时火焰颜色相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯元素的近似相对原子质量为35 | B. | 氯元素的某种同位素的质量数为35 | ||
| C. | 氯元素的中子数为18 | D. | 氯原子的质量为34.969 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂离子电池放电时电池反应为LiMO2+C6Li1-x═C6Li+Li1-xMO2 | |
| B. | 锂离子电池充电时电池内部Li+向负极移动 | |
| C. | 锂离子电池放电时电池内部电流从负极流向正极 | |
| D. | 锂离子电池充电时阳极反应为C6Li1-x+xLi++xe-═C6Li |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
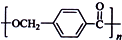 的路线:
的路线: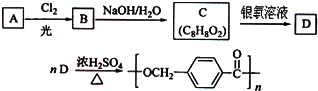
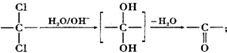
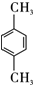 .
. ,该反应过程中生成的不稳定中间体的结构简式应是
,该反应过程中生成的不稳定中间体的结构简式应是 .
.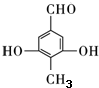 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取a克混合物充分加热,得b1克固体 | |
| B. | 取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b2克固体 | |
| C. | 取a克混合物与足量浓盐酸充分反应,逸出气体用碱石灰吸收,增重b3克 | |
| D. | 取a克混合物与足量Ba(0H)2溶液充分反应,过滤、洗涤、烘干,得b4克固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com