
| A. | 锂离子电池放电时电池反应为LiMO2+C6Li1-x═C6Li+Li1-xMO2 | |
| B. | 锂离子电池充电时电池内部Li+向负极移动 | |
| C. | 锂离子电池放电时电池内部电流从负极流向正极 | |
| D. | 锂离子电池充电时阳极反应为C6Li1-x+xLi++xe-═C6Li |
分析 A.在得失电子相同条件下,将正负极电极反应式相加即得电池反应式;
B.充电时电解质中阳离子向阴极移动;
C.放电时,在原电池内部阴阳离子定向移动形成电流;
D.充电时阳极反应式与正极反应式正好相反.
解答 解:A.在得失电子相同条件下,将正负极电极反应式相加即得电池反应式,所以该电池反应式为
C6Li+Li1-xMO2=LiMO2+C6Li1-x,故A错误;
B.充电时电解质中阳离子向阴极移动,所以锂离子电池充电时电池内部Li+向阴极移动,故B错误;
C.放电时,在原电池内部阴阳离子定向移动形成电流,电流从负极流向正极,故C正确;
D.充电时阳极反应式与正极反应式正好相反,所以阳极反应式为LiMO2-x e-=Li1-xMO2+xLi+,故D错误;
故选C.
点评 本题考查化学电源新型电池,为高频考点,明确原电池、电解池的工作原理即可解答,注意离子、电流、电子移动方向,难点是电极反应式的书写.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
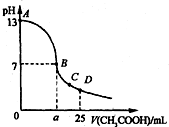 25℃时,在25mL 0.1mol•Lˉ1的NaOH溶液中,逐滴加入0.2mol•Lˉ1的CH3COOH溶液.溶液pH的变化曲线如图所示.下列分析的结论中,错误的是( )
25℃时,在25mL 0.1mol•Lˉ1的NaOH溶液中,逐滴加入0.2mol•Lˉ1的CH3COOH溶液.溶液pH的变化曲线如图所示.下列分析的结论中,错误的是( )| A. | C点时c(CH3COOˉ)>c(Na+)>c(H+)>c(OHˉ) | |
| B. | D点时c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| C. | 曲线上A、B间任一点,溶液中都有:c(Na+)>c(CH3COOˉ)>c(OHˉ)>c(H+) | |
| D. | B点的横坐标a>12.5 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成40.0LN2(标况) | B. | 有0.250molKNO3被氧化 | ||
| C. | 共生成0.625mol氧化物 | D. | 共转移电子1.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素的原子只有还原性,离子只有氧化性 | |
| B. | 金属元素在化合物中一定显正价 | |
| C. | 金属单质都可以和酸反应置换出氢气 | |
| D. | 金属元素的单质在常温下均为固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种物质中一定有共价化合物 | B. | 四种物质中一定有Ba(OH)2 | ||
| C. | 丙溶液加热蒸干可得原无水溶质 | D. | 丁溶液中含有HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L O2作氧化剂时转移电子数一定为NA | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| C. | 已知3BrF3+5H2O═HBrO3+Br2+9HF+O2↑ 如果有5 mol H2O参加氧化还原反应,则由水还原的BrF3分子数目为3NA | |
| D. | 142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 双键、三键中都含有π键 | |
| B. | 成键原子间原子轨道重叠愈多,共价键愈牢固 | |
| C. | 因每个原子未成对的电子数是一定的,故与其配对的原子个数也一定 | |
| D. | 所有原子轨道在空间中都有自己的方向性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com