

分析 (1)乙醛的沸点低,温度较高时,乙醛挥发,使得反应产率降低,所以该反应需控制反应温度为20℃,控制温度的方法可以通过水水浴的方式;
(2)仪器a为冷凝管,对反应混合物进行冷凝回流;氯化铝水解可得氯化氢和氢氧化铝,氯化铝极易水解,所以要防止烧杯中的水蒸气进入三口烧瓶,引起氯化铝的水解,装置b处用干燥剂吸水;
(3)1,1-二苯乙烷的密度小于水,据此判断产品的位置,洗涤操作中,第二次水洗主要是除去氯化铝、盐酸和碳酸钠(或洗掉可溶性无机物),洗涤后加入少量无水硫酸镁固体,目的是吸收产品中少量的水分,也可以用氯化钙代替;
(4)蒸馏提纯时,如果温度计水银球的位置在支管口下面,收集到的馏份的沸点要低于水银球的位置在支管口处的收集到的馏份,据此判断;
(5)120mL苯(密度0.88g/mL)的物质的量为$\frac{120×0.88}{78}$mol=1.35mol,3.7g乙醛的物质的量为$\frac{3.7}{44}$mol=0.084mol,根据苯、乙醛为原料制备1,1-二苯乙烷的方程式可知,苯过量,所以产品的理论产量为0.084mol×182g/mol=15.3g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)乙醛的沸点低,温度较高时,乙醛挥发,使得反应产率降低,所以该反应需控制反应温度为20℃,控制温度的方法可以通过水水浴的方式,即将三口烧瓶置于20℃的水浴中,
故答案为:将三口烧瓶置于20℃的水浴中;乙醛的沸点低,温度较高,乙醛挥发,产率降低(或温度高会发生副反应);
(2)仪器a为冷凝管,对反应混合物进行冷凝回流,氯化铝水解可得氯化氢和氢氧化铝,反应方程式为AlCl3+3H2O Al(OH)3+3HCl,氯化铝极易水解,所以要防止烧杯中的水蒸气进入三口烧瓶,引起氯化铝的水解,装置b处用干燥剂吸水,防止烧杯中的水蒸气进入反应器中与三氯化铝反应,
故答案为:冷凝、回流;AlCl3+3H2O Al(OH)3+3HCl;防止烧杯中的水蒸气进入反应器中与三氯化铝反应;
(3)1,1-二苯乙烷的密度小于水,所以产品在上层,洗涤操作中,第二次水洗主要是除去氯化铝、盐酸和碳酸钠(或洗掉可溶性无机物),洗涤后加入少量无水硫酸镁固体,目的是吸收产品中少量的水分,也可以用氯化钙代替,
故答案为:上;洗掉氯化铝、盐酸和碳酸钠(或洗掉可溶性无机物);氯化钙;
(4)蒸馏提纯时,如果温度计水银球的位置在支管口下面,收集到的馏份的沸点要低于水银球的位置在支管口处的收集到的馏份,故选ab;
(5)120mL苯(密度0.88g/mL)的物质的量为$\frac{120×0.88}{78}$mol=1.35mol,3.7g乙醛的物质的量为$\frac{3.7}{44}$mol=0.084mol,根据苯、乙醛为原料制备1,1-二苯乙烷的方程式可知,苯过量,所以产品的理论产量为0.084mol×182g/mol=15.3g,所以1,1-二苯乙烷的产率约为$\frac{7.8g}{15.3g}$×100%=51%,
故答案为:51%.
点评 本题考查制备实验方案设计,侧重考查学生分析、基本操作等能力,明确实验原理是解本题关键,知道每个仪器作用、物质的性质,学生对于制备实验较陌生,对于有机物性质较陌生,从而导致得分率较低,为学习难点.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:解答题
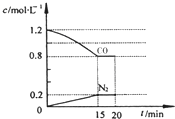 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂离子电池放电时电池反应为LiMO2+C6Li1-x═C6Li+Li1-xMO2 | |
| B. | 锂离子电池充电时电池内部Li+向负极移动 | |
| C. | 锂离子电池放电时电池内部电流从负极流向正极 | |
| D. | 锂离子电池充电时阳极反应为C6Li1-x+xLi++xe-═C6Li |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
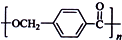 的路线:
的路线: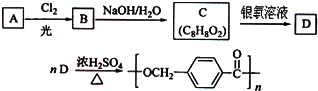
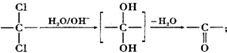
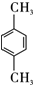 .
. ,该反应过程中生成的不稳定中间体的结构简式应是
,该反应过程中生成的不稳定中间体的结构简式应是 .
.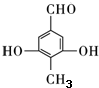 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
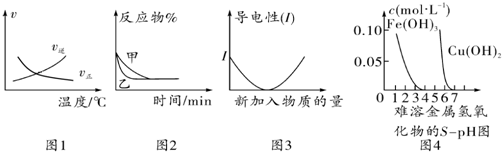
| A. | 根据图1可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H<0 | |
| B. | 图2可能表示压强对可逆反应 A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 图3可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. | 根据图4,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量Cu至pH在4左右 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuFeS2既是氧化剂又是还原剂,硫元素既被氧化又被还原 | |
| B. | 每生成1molSO2转移6mol电子 | |
| C. | SO2既是氧化产物又是还原产物,FeS只是还原产物 | |
| D. | 每转移1.2 mol电子,有0.3 mol氧气被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取a克混合物充分加热,得b1克固体 | |
| B. | 取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b2克固体 | |
| C. | 取a克混合物与足量浓盐酸充分反应,逸出气体用碱石灰吸收,增重b3克 | |
| D. | 取a克混合物与足量Ba(0H)2溶液充分反应,过滤、洗涤、烘干,得b4克固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com