
| A. | 漂白粉溶液 | B. | 次氯酸钠溶液 | C. | 氯化钙溶液 | D. | 二氧化硫 |
分析 具有强氧化的物质具有漂白性,如氯水、HClO、过氧化氢、过氧化钠等,二氧化硫与有色物质化合生成无色物质,也具有漂白性,活性炭具有吸附性能使有色物质褪色,以此来解答.
解答 解:A.漂白粉的有效成分为次氯酸钙,能生成具有漂白性的HClO,可使红色布条褪色,故A不选;
B.次氯酸钠溶液能生成具有漂白性的HClO,可使红色布条褪色,故B不选;
C.氯化钙溶液不具有强氧化性、漂白性,则不能使有色布条褪色,故C选;
D.二氧化硫与有色物质化合生成无色物质,能使有色布条褪色,故D不选.
故选C.
点评 本题考查漂白性,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意归纳常见的具有漂白性的物质及其漂白原理,明确物质的性质即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
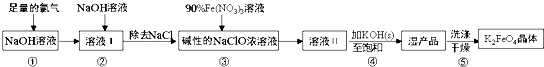
| A. | 步骤③中氧化剂与还原剂的物质的量之比为3:2 | |
| B. | 步骤④中Na2FeO4转变为湿产品是因为K2FeO4溶解度更小 | |
| C. | 步骤⑤中的洗涤剂可用CH3COOK和异丙醇来配制 | |
| D. | 配制90%Fe(NO3)3溶液必需的玻璃仪器有容量瓶、烧杯、量筒、玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂离子电池放电时电池反应为LiMO2+C6Li1-x═C6Li+Li1-xMO2 | |
| B. | 锂离子电池充电时电池内部Li+向负极移动 | |
| C. | 锂离子电池放电时电池内部电流从负极流向正极 | |
| D. | 锂离子电池充电时阳极反应为C6Li1-x+xLi++xe-═C6Li |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
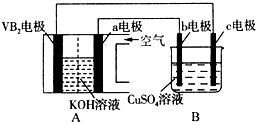 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )| A. | 电解过程中,c电极表面先有红色物质析出,然后有气泡产生 | |
| B. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| C. | 外电路中电子由c电极流向VB2电极 | |
| D. | 若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
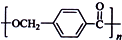 的路线:
的路线: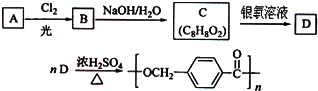
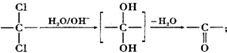
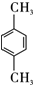 .
. ,该反应过程中生成的不稳定中间体的结构简式应是
,该反应过程中生成的不稳定中间体的结构简式应是 .
.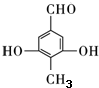 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
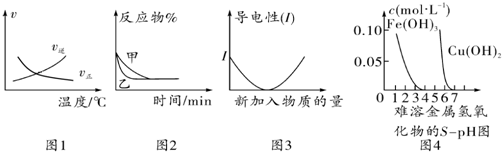
| A. | 根据图1可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H<0 | |
| B. | 图2可能表示压强对可逆反应 A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 图3可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. | 根据图4,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量Cu至pH在4左右 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuFeS2既是氧化剂又是还原剂,硫元素既被氧化又被还原 | |
| B. | 每生成1molSO2转移6mol电子 | |
| C. | SO2既是氧化产物又是还原产物,FeS只是还原产物 | |
| D. | 每转移1.2 mol电子,有0.3 mol氧气被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,将m1克锌加入到m2克20%的盐酸中放出nLH2,则转移电子数为$\frac{n{N}_{A}}{11.2}$ | |
| B. | 0.1mol/L的100mL H2SO3溶液中,含有的离子数约为0.03NA | |
| C. | 9gD2O中含有的电子数为5NA | |
| D. | 120g由NaHSO4和KHSO3组成的混合物中共含有3NA的阴阳离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com