
在CH3COONa溶液中各离子的浓度由大到小排列顺序正确的是
A.c(Na+)﹥c(CH3COO-)﹥c(OH-)﹥c(H+) B.c(CH3COO-)﹥c(Na+)﹥c(OH-)﹥c(H+)
C.c(Na+)﹥c(CH3COO-)﹥c(H+)﹥c(OH-) D.c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
科目:高中化学 来源: 题型:
一定条件下进行反应:COCl2(g) Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入
Cl2(g)+CO(g),向2.0 L恒容密闭容器中充入
1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法正确的是
A.保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol·L-1,则反应的ΔH<0
B.若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变
C.保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,
反应达到平衡前的速率:v(正)<v(逆)
D.保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,
Cl2的转化率小于60%
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.糖类、油脂、蛋白质在一定条件都能发生水解反应
B.苯只能发生取代反应,不能发生加成反应
C.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O
D.溴乙烷与NaOH的乙醇溶液共热生成乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式书写正确且对应的△H与括号内表述相符的是
A.2H2 (g) + O2 (g) = 2H2O (l) ΔH=-571.6 kJ/mol(燃烧热)
B.NaOH(aq)+ CH3COOH(aq)=CH3COONa(aq)+H2O(l);△H=-57.3kJ/mol(中和热)
C.H2O (g) = H2 (g) +  O2 (g) ΔH=-242 kJ/mol (反应热)
O2 (g) ΔH=-242 kJ/mol (反应热)
D.C(s)+ O2 ( g ) = CO2(g) ΔH=-393.5 kJ/mol(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,属于水解反应的是
A.H2SO3+H2O HSO3- + H3O+ B.CO32— + H2O
HSO3- + H3O+ B.CO32— + H2O HCO3— + OH—
HCO3— + OH—
C.NH3·H2O NH4+ +OH- D.HS— + H2O
NH4+ +OH- D.HS— + H2O S2— + H3O+
S2— + H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学平衡常数K的说法中正确的是
A.平衡常数的大小与起始浓度有关 B.K值越大,反应的转化率越小
C.K值越大,反应的转化率越大 D.温度越高,K值越大
查看答案和解析>>
科目:高中化学 来源: 题型:
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式 ___________________ 。

(2)已知:N2(g)+ O2(g)=2 NO(g) △H=+180 kJ • mol-1
2NO(g)+2 CO(g)=N2(g) + 2 CO2(g) △H=-746 kJ • mol-1
则反应CO(g) + O2(g)=CO2(g)的 △H= kJ • mol-1。
O2(g)=CO2(g)的 △H= kJ • mol-1。
(3)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 。
2NH3(g) △H <0, 若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 。
(4) 在固定体积的密闭容器中,1.0×103 kPa时,发生反应 N2(g)+3H2(g) 2NH3(g) △H<0,
2NH3(g) △H<0,
其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
① K1 K2(填写“>”、“=”或“<”)
②下列各项能说明上述合成氨反应一定达到平衡状态的是 (填字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.NH3的浓度保持不变
c.容器内压强保持不变 d.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各选项最后的物质是要制取的物质,其中能够得到的是
A.CaCO3  CaO
CaO  Ca(OH)2
Ca(OH)2  NaOH溶液
NaOH溶液
B. Cu CuO
CuO CuSO4溶液
CuSO4溶液 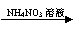 Cu(NO3)2溶液
Cu(NO3)2溶液
C.KMnO4 O2
O2 SO3
SO3  H2SO4
H2SO4
D .NH3  NO
NO  NO2
NO2  HNO3
HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学—物质结构与性质(15分)
化学—物质结构与性质(15分)
乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2与水反应生成乙炔的反应方程式为________.
(2)比较第二周期元素C、N、O三种元素的第一电离能从大到小顺序为 ______(用元素符号表示),用原子结构观点加以解释______。
(3)CaC中C22-与O22+互为等电子体,O22+的电子式可表示为______;1molO22+中含有的Π键数目为_______。
(4)CaC2晶体的晶胞结构与NaCI晶体的相似(如图所示),
但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个
方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-
数目为______。
(5)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。
Cu+基态核外电子排布式为 _______。
(6)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈
分子中碳原子轨道杂化类型是______;分子中处于同一
直线上的原子数目最多为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com