
【题目】I、铁是生产、生活及生命中的重要元素。
(1)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合能力。药品美蓝是其有效的解毒剂,解毒时美蓝发生_____反应(填“氧化”或“还原”)。
(2)普通铁粉与水蒸气在高温下反应生成铁的某种氧化物和氢气,该氧化物和氢气在高温下发生逆反应得到“引火铁”。 “引火铁”是一种极细的铁粉,它在空气中可以自燃,其原因是_____________。
Ⅱ、在1 L 2 mol·L-1稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入铁粉的物质的量的关系如图所示:
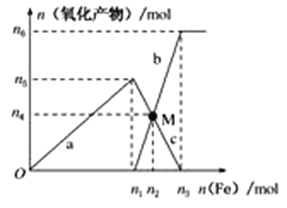
回答下列问题:
(1)写出加入n1mol铁所发生反应的离子方程式_______________________________。
(2)整个过程中转移电子的数目是________。
(3)若M点时再加入V L 2 mol·L-1的稀硝酸,恰好反应完全,则V为___________。
(4)研究表明硝酸的浓度越小,反应后氮的化合价越低。在极稀的硝酸溶液中加入少量铁粉,生成NH4+的离子方程式为___________________________________________________。
【答案】氧化 铁粉表面积大反应速率快 Fe+4H++NO3-=2H2O+NO↑+Fe3+ 2NA 0.2 8Fe+30H++3NO3-=3NH4++8Fe3++9H2O
【解析】
I(1)根据美蓝能将高铁血红蛋白还原为低铁血红蛋白使其恢复与氧结合的能力进行分析;
(2)根据固体接触面积与化学反应速率的关系分析;
Ⅱ 向稀硝酸中加入铁粉时,发生两个过程,开始先生成Fe(NO3)3,反应方程式为:Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O,当铁过量时,过量的铁与Fe(NO3)3 继续反应生成 Fe(NO3)2,反应方程式为:2Fe(NO3)3+Fe=3 Fe(NO3)2,由此分析解答.
(1)美蓝能将高铁血红蛋白还原为低铁血红蛋白使其恢复与氧结合的能力,因此解毒时美蓝发生氧化反应;
答案:氧化
(2)铁粉与水蒸气反应,接触面积越大,反应速率越快;
答案:铁粉表面积大反应速率快
Ⅱ(1)因为硝酸足量,因此0~n1mol,铁与稀硝酸反应,生成硝酸铁,一氧化氮和水,离子方程式为Fe+4H++NO3-=2H2O+NO↑+Fe3+;
答案:Fe+4H++NO3-=2H2O+NO↑+Fe3+
(2)整个过程中铁最终被氧化为硝酸亚铁,其中硝酸的物质的量为2mol/L×1L=2mol;
Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O 转移电子数
4mol 1mol 3NA
2mol 0.5mol 1.5NA
2Fe(NO3)3+Fe=3 Fe(NO3)2 转移电子数
2mol 2NA
0.5mol0.5NA
转移电子数为1.5NA+0.5NA=2NA
答案:2NA
(3)M点时铁离子和亚铁离子物质的量相等,再加入V L 2 mol·L-1的稀硝酸,恰好反应完全,亚铁离子被氧化为铁离子;
Fe + 4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O
1mol 4mol 1mol
2mol 0.5mol
2Fe(NO3)3+Fe= 3 Fe(NO3)2
2mol 3mol
![]() n(Fe2+)
n(Fe2+)
根据M点时铁离子和亚铁离子物质的量相等可知0.5-![]() =n(Fe2+),得n(Fe2+)=0.3mol
=n(Fe2+),得n(Fe2+)=0.3mol
3Fe(NO3)2+4HNO3=3Fe(NO3)3+NO↑+2H2O
3mol 4mol
0.3mol 2V
![]() =
=![]() ,得V=0.2L;
,得V=0.2L;
答案:0.2
(4)极稀的硝酸溶液中加入少量铁粉,硝酸被还原为铵盐,铁粉少量被氧化为硝酸铁,离子方程式为8Fe+30H++3NO3-=3NH4++8Fe3++9H2O;
答案:8Fe+30H++3NO3-=3NH4++8Fe3++9H2O


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】写出下列水溶液中的电离方程式或发生反应的离子方程式:
(1)小苏打溶于水___;
(2)用稀硫酸除掉镁条表面的氧化膜___;
(3)用胃舒平(有效成分是Al(OH) 3)治疗胃酸(主要成分是盐酸)过多___;
(4)用锌粉除去硫酸钾溶液中的Cd2+杂质(置换反应)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)“水玻璃”中溶质的化学式为____,乙二醇的结构简式为____。
(2)AlCl3熔沸点较低,熔融状态不导电,则其晶体类型为____晶体。
(3)浓硝酸需避光保存在棕色试剂瓶的原因是____。(用化学方程式解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求计算、整理化简并填空:
(1)若20g密度为ρgcm﹣3的硝酸钙溶液里含1gCa2+,则NO3-的物质的量浓度是____。
(2)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg/mol。若阿伏加德罗常数的值用NA表示,则:
①该气体所含原子总数为___个。
②该气体在标准状况下的体积为____L。
③该气体溶于1L水中(不考虑反应),形成的溶液密度为ρg/cm3,则该溶液的物质的量浓度为____molL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备高纯硅有多种方法,其中的一种工艺流程如下:
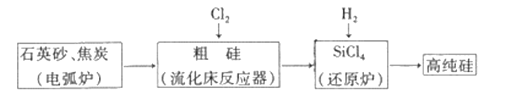
已知:流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等。下列说法正确的是
A. 电弧炉中发生的反应为C+SiO2![]() CO2↑+Si
CO2↑+Si
B. SiCl4进入还原炉之前需要经过蒸馏提纯
C. 每生产l mol高纯硅,需要44. 8L Cl2(标准状况)
D. 该工艺Si的产率高,符合绿色化学要求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系有反应物和生成物总共有5种物质:O2 、H2CrO4 、Cr(OH)3 、H2O、H2O2。已知该反应中H2O2 发生如下变化过程:H2O2 → O2 ,则有:
(1)该反应中的氧化产物_________________________;
(2)配平该反应的化学方程式并用单线桥表示电子转移情况:__________________________________________。
(3)现有反应:3BrF3 + 5H2O = HBrO3 + Br2 + 9HF + O2↑,已知BrF3中F的化合价为-1价,则有该反应中的氧化剂是____________,若生成0.5 mol Br2,则反应过程中转移电子为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1,Na2O2(s)+CO2(g)=Na2CO3(s)+ ![]() O2(g) ΔH=-266kJ·mol-1,试回答:
O2(g) ΔH=-266kJ·mol-1,试回答:
(1)CO的燃烧热ΔH=_______________。
(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为:________。
(3)工业废气中的CO2可用碱液吸收,所发生的反应如下:CO2(g)+2NaOH(aq)=Na2CO3(aq)+H2O(l) ΔH=-a kJ·mol-1,CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-bkJ·mol-1,则:
①CO2(g)+H2O(l)+Na2CO3(aq)=2NaHCO3(aq)的ΔH=________kJ·mol-1(用含a、b的代数式表示)。
②标况下,11.2LCO2与足量的NaOH溶液充分反应后,放出的热量为_______kJ(用含a或b的代数式表示)。
(4)根据以下三个热化学方程式:2H2S(g)+3O2(g)= 2SO2 (g) +2H2O (l) ΔH=-Q1kJ·mol-1,2H2S(g)+O2(g)= 2S (s) +2H2O (l) ΔH=-Q2kJ·mol-1,2H2S(g)+O2(g)=2 S (s) +2H2O (g) ΔH=-Q3kJ·mol-1,判断Q1、Q2、Q3的大小关系是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,等体积的NH3和CH4两种气体,下列有关说法错误的是
A.所含分子数目相同B.所含氢原子物质的量之比为3∶4
C.质量之比为16∶17D.密度之比为17∶16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素①~⑩在周期表中的位置如下表所示:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
回答下列问题:
(1)最外层电子数为2的元素有________(填元素符号);⑨的简单离子结构示意图为________,①与⑥以原子个数比为1:1形成的化合物的电子式为________,用电子式表示⑦与⑩形成化合物的过程________________________。
(
(3)高温灼烧⑦与⑩两种元素形成的化合物时,火焰呈________色。⑧可用于航空航天合金材料的制备,工业上冶炼该单质的化学方程式为________。
(4)④、⑤、⑥的气态氢化物中最稳定的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com