
����Ŀ����1 mol ���ۼ������յ��������γ�1 mol ���ۼ����ͷŵ�������Ϊ���ܡ���֪��H��H����Ϊ436 kJ /mol��H��N����Ϊ391 kJ /mol�� N2 (g)+ 3H2(g) ![]() 2NH3(g) ��H����92.4 kJ /mol������˵������ȷ����(����)
2NH3(g) ��H����92.4 kJ /mol������˵������ȷ����(����)
A. H��H��N��N���ι�
B. N��N����ԼΪ946 kJ/mol
C. �ϳɰ���Ӧѡ���ʵ��Ĵ�����Ϊ�����H2��ת����
D. 0.5 mol N2��1.5 mol H2����������³�ַ�Ӧ���ų�����Ϊ46.2 kJ
���𰸡�B
��������
���ⷴӦ�ȵ����������жϼ����յ��������γɷ�Ӧ���л�ѧ���ų�������֮����������N��N����Ϊx��������Ȼ�ѧ����ʽ��֪x+3��436 kJ/mol��2��3��391 kJ/mol����92.4 kJ/mol�����x��946 kJ/mol������B��ȷ��A��H��H��N��N����С������N��N��H��H���ι̣�A����ȷ��C������ֻ�ܸı䷴Ӧ���ʣ������ܸı�ƽ��״̬�����Ժϳɰ���Ӧѡ���ʵ��Ĵ�������Ϊ�����H2��ת���ʣ�C����ȷ��D�����ڸ÷�Ӧ�ǿ��淴Ӧ�����0.5 mol N2��1.5 mol H2����������³�ַ�Ӧ���ų�����С��46.2 kJ��D����ȷ����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��:Ba(OH)2�����壩��CuSO4�����壩��CH3COOH��Һ̬����Щ����Ϊʲô��Ϊһ�࣬������Щ���ʻ����Ժ����ǹ�Ϊһ��
A.75%�ľƾ���Һ
B.�����
C.Al(OH)3����
D.ţ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������AG��ʾ��Һ����ȣ������ʽΪ��AG=lg[ ]�������£�ʵ��������0.10 mol/L ��������Һ�ζ�10 mL 0.10 mol/L MOH��Һ���ζ�������ͼ��ʾ������˵����ȷ����
]�������£�ʵ��������0.10 mol/L ��������Һ�ζ�10 mL 0.10 mol/L MOH��Һ���ζ�������ͼ��ʾ������˵����ȷ����

A. �õζ����̿�ѡ���̪��Ϊָʾ��
B. C�������������Ϊ10mL
C. ��B������������Һ���Ϊ5mL��������Һ�У�c(M+)+2c(H+)=c(MOH)+2c(OH)
D. �ζ������д�A�㵽D����Һ��ˮ�ĵ���̶�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ӿ����۵�ĸߵ;���������������֮����롢�����ܵĴ�С������ѧ֪ʶ�ж�KCl��NaCl��CaO��BaO���־����۵�ĸߵ�˳����(����)
A. KCl��NaCl��BaO��CaO B. NaCl��KCl��CaO��BaO
C. CaO��BaO��KCl��NaCl D. CaO��BaO��NaCl��KCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ҡ����������ʴ�����ͼ��ʾ��ת����ϵ(ͼ����������ʾһ��ת��)�����и�������ת������������˹�ϵ����

�� | �� | �� | |
A | NaOH | Na2CO3 | NaHCO3 |
B | AlCl3 | Al(OH)3 | NaAlO2 |
C | NH3 | N2 | HNO3 |
D | S | SO2 | H2SO4 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1.0 L�����ܱ������з���0.10 mol X����һ���¶��·�����Ӧ��X(g)![]() Y(g)��Z(g) ��H��0��������������ѹǿp�淴Ӧʱ��t�ı仯��ϵ��ͼ��ʾ�����·�����ȷ����( )
Y(g)��Z(g) ��H��0��������������ѹǿp�淴Ӧʱ��t�ı仯��ϵ��ͼ��ʾ�����·�����ȷ����( )
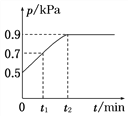
A. ���¶��´˷�Ӧ��ƽ�ⳣ��K��3.2
B. �ӷ�Ӧ��ʼ��t1ʱ��ƽ����Ӧ����v(X)��![]() mol��L��1��min��1
mol��L��1��min��1
C. �����ƽ����ϵ��Y�İٷֺ������ɼ���һ������X
D. �����������䣬�ٳ���0.1 mol����X��ƽ�������ƶ���X��ת���ʼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z��ԭ�������������ӣ�W��X��Y��Z��ɵĵ��ʿɷ�������ͼ��ʾ�Ļ�ѧ��Ӧ��B�������������Һ����Y��Z��ɵĻ������ˮ��Һ�����ԡ�����˵���������

A. ���Ӱ뾶��Z>Y
B. A��B�ķ�Ӧһ���ǻ��Ϸ�Ӧ
C. Y��Z���ߵ�����������ˮ�����ܷ�����Ӧ
D. �������ʵ�����A��Cͬʱ����ˮ�У�������Һ��pH>7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷ϱ���(��Ҫ�ɷ�ΪBaS2O3��������SiO2)Ϊԭ�������ߴ�������������������

��֪��Ksp(BaS2O3)=6.96��10-11��Ksp(BaF2)=1.0��10-6
��1����������ʱ������SO2�⣬���е���ɫ�������ɡ��÷�Ӧ�����ӷ���ʽΪ____________��
��2����Һ����Ҫ�ɷ���_____________��(�ѧʽ)
��3����ҵ�Ͽ��ð�ˮ����SO2����ͨ�����ʹ��ת��Ϊ��̬���ʡ���ת�����������뻹ԭ�������ʵ���֮��Ϊ_______________��
��4������NaOH��Һ��Ŀ�����к����������������˹�������ԭ����_____________(�����ӷ�Ӧ����ʽ��ʾ)��
��5������BaF2�ķ�Ӧ�Ļ�ѧ����ʽΪ______________��
�����÷�Ӧ�¶ȹ��ߣ��������c(F-)���͵�ԭ����___________________��
���о��������ʵ�����NH4F�ı������������BaF2�IJ��ʺʹ��ȡ���Ũ��Ϊ0.1mol��L-1��BaCl2��Һ��0.22 mol��L-1NH4F��Һ�������ϣ�������Һ��c(Ba2+)=______mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�������ԭ���������
A. ������ڵ�NaCl����ȡNa
B. ������ڵ�AlCl3����ȡAl
C. CO�Ȼ�ԭFe2O3��ȡFe
D. �������ȷ�Ӧԭ����4Al+3MnO2![]() 3Mn+2 Al2O3
3Mn+2 Al2O3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com