
【题目】下列有关电解质溶液的说法正确的是 ( )
A. 向0.1mol![]() CH3COOH溶液中加入少量水,溶液中
CH3COOH溶液中加入少量水,溶液中 减小
减小
B. 向0.1mol![]() CH3COONa溶液加入少量水,溶液中
CH3COONa溶液加入少量水,溶液中 不变
不变
C. 向盐酸中加入氨水至中性,溶液中
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中 减小
减小
【答案】B
【解析】A.向0.1molL﹣1CH3COOH溶液中加入少量水,加水促进醋酸的电离,氢离子的物质的量增大,醋酸的物质的量减小,所以溶液中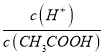 增大,选项A错误;B.向0.1molL﹣1CH3COONa溶液加入少量水,水解常数Kh=
增大,选项A错误;B.向0.1molL﹣1CH3COONa溶液加入少量水,水解常数Kh= 只与温度有关,所以
只与温度有关,所以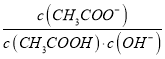 =
=![]() 保持不变,选项B正确;C.向盐酸中加入氨水至中性,溶液中电荷守恒为c(Cl﹣)+c(OH﹣)=c(NH4+)+c(H+),显中性,即c(OH﹣)=c(H+),所以c(Cl﹣)=c(NH4+),
保持不变,选项B正确;C.向盐酸中加入氨水至中性,溶液中电荷守恒为c(Cl﹣)+c(OH﹣)=c(NH4+)+c(H+),显中性,即c(OH﹣)=c(H+),所以c(Cl﹣)=c(NH4+),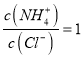 ,选项C错误;D.AgCl、AgBr的饱和溶液中存在AgCl(s)+Br﹣AgBr(s)+Cl﹣,该反应的平衡常数K=
,选项C错误;D.AgCl、AgBr的饱和溶液中存在AgCl(s)+Br﹣AgBr(s)+Cl﹣,该反应的平衡常数K=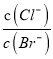 ,向溶液中加入少量AgNO3,K不变,选项D错误。答案选B。
,向溶液中加入少量AgNO3,K不变,选项D错误。答案选B。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于“物质的量”、“摩尔”和“摩尔质量”等的叙述中正确的是( )
A.物质的量是一个基本的物理量,单位是摩尔
B.物质的摩尔质量等于其相对分子(原子)质量
C.0.12 kg 12C中所含的碳原子数为阿伏加德罗常数
D.1 mol任何物质中都含有阿伏加德罗常数个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将如图所示实验装置的K闭合,下列判断正确的是( )
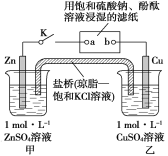
A.电子沿Zn→a→b→Cu路径流动
B.Cu电极上发生还原反应
C.片刻后甲池中c(SO![]() )增大
)增大
D.片刻后可观察到滤纸b点变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是( )
A.Ca2+ Na+ NO3- Cl﹣B.Na+ K+ CO32- H+
C.Ba2+ Cu2+ SO42- OH﹣D.Cu2+ K+ CO32- Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )

A. 图中a点对应的是AgBr的不饱和溶液
B. 在t °C时,AgBr的Ksp为 4.9×10-13
C. 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
D. 在t °C时,AgCl(s)+Br-(aq)![]() AgBr(s)+C1- (aq)的平衡常数K≈816
AgBr(s)+C1- (aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面列出了几组物质,请将物质的序号填写在空格上:①淀粉和纤维素;②D2O与T2O; ③12C和14C;④金刚石与石墨;⑤![]() ;⑥CH4和异丁烷;⑦葡萄糖和果糖;⑧淀粉和果糖
;⑥CH4和异丁烷;⑦葡萄糖和果糖;⑧淀粉和果糖
(1)互为同位素的是________;
(2)互为同分异构体的是________;
(3)互为同素异形体是________;
(4)互为同系物的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为_________________,未成对电子数为________________。
(2)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
①H2O的沸点___ (填“高于”或“低于”)H2S,原因是_______;H2O中O的杂化形式为_____。H2O是_____分子(填“极性”或“非极性”)。
②[Co(NH3)4(H2O)2]Cl3Co3+配位数为___。阳离子的立体构型是___________。[Co(NH3)4(H2O)2]Cl3若其中有两个NH3分子被Cl取代,所形成的[Co(NH3)2(H2O)2] 3+的几何异构体种数有(不考虑光学异构)___________种。
(3)金属钴是由______键形成的晶体;CoO、FeO的晶体结构类型均与氯化钠的相同,Co2+和Fe2+的离子半径分别为74.5pm和78pm,则熔点CoO______FeO。
(4)一氧化钴的晶胞如图,则在每个Co2+的周围与它最接近的且距离相等的Co2+共有_____个,若晶体中Co2+与O2-的最小距离为acm,则CoO的晶体密度为_______(用含NA和a的代数式表示。结果g/cm3,已知:M(Co)=59g/mol;M(O)=16g/mol,设阿佛加德罗常数为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中●和○代表不同元素的原子。

关于此反应的说法不正确的是
A. 反应物总能量一定低于生成物总能量 B. 一定属于可逆反应
C. 一定有非极性共价键断裂 D. 一定属于氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com