
【题目】下面列出了几组物质,请将物质的序号填写在空格上:①淀粉和纤维素;②D2O与T2O; ③12C和14C;④金刚石与石墨;⑤![]() ;⑥CH4和异丁烷;⑦葡萄糖和果糖;⑧淀粉和果糖
;⑥CH4和异丁烷;⑦葡萄糖和果糖;⑧淀粉和果糖
(1)互为同位素的是________;
(2)互为同分异构体的是________;
(3)互为同素异形体是________;
(4)互为同系物的是________。
【答案】 ③ ⑦ ④ ⑥
【解析】具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素;具有相同分子式而结构不同的化合物互为同分异构体;同素异形体是同种元素形成的不同单质;结构相似分子组成相差若干个CH2原子团的有机物互为同系物,据此解答。
(1)具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素,则12C和14C互为同位素,答案选③;
(2)具有相同分子式而结构不同的化合物互为同分异构体,葡萄糖和果糖的分子式均是C6H12O6,结构不同,二者互为同分异构体,答案选⑦;
(3)同素异形体是同种元素形成的不同单质,金刚石与石墨均是碳元素形成的不同单质,二者互为同素异形体,答案选④;
(4)结构相似分子组成相差若干个CH2原子团的有机物互为同系物,CH4和异丁烷均是烷烃,结构相似,二者互为同系物,答案选⑥。
淀粉和纤维素均是多糖,都是混合物;D2O与T2O均表示水分子;![]() 是同一种物质;淀粉是多糖,果糖是单糖,不是同系物关系。
是同一种物质;淀粉是多糖,果糖是单糖,不是同系物关系。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列事实对应的离子方程式不正确的是
A. 用碳酸钠溶液处理锅炉中的硫酸钙水垢:CaSO4(s)+ ![]() (aq)
(aq) ![]() CaCO3(s)+
CaCO3(s)+ ![]() (aq)
(aq)
B. 用加热的方法降低自来水中钙离子浓度:Ca2++2H![]()
![]() CaCO3 ↓+H2O+CO2↑
CaCO3 ↓+H2O+CO2↑
C. 用醋酸清洗热水壶中的碳酸钙水垢:2H++CaCO3=== Ca2++H2O+CO2↑
D. 用肥皂(主要成分C17H35COONa)检验含有较多钙离子的硬水:2C17H35COO—+Ca2+ === (C17H35COO)2Ca↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,加入0.100molCO气体和0.080molCuO固体,800℃时发生如下反应:2CuO(s)+CO(g)![]() Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
(1)用CO表示前2min内的化学反应速率=
(2)计算此反应在800C时的化学平衡常数k=
(3)若向平衡后的体系中加入CO和CO2各0.05mol,则此时V(正) V(逆)
(4)用来还原CuO的CO可以用C和水蒸气反应制得。
已知:![]() H=-393.5kJ/mol
H=-393.5kJ/mol
![]() H=-566kJ/mol
H=-566kJ/mol
![]() H=-571.6kJ/mol
H=-571.6kJ/mol
则C(s)+H2O(g)![]() CO(g)+H2(g) H= 。
CO(g)+H2(g) H= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是 ( )
A. 向0.1mol![]() CH3COOH溶液中加入少量水,溶液中
CH3COOH溶液中加入少量水,溶液中 减小
减小
B. 向0.1mol![]() CH3COONa溶液加入少量水,溶液中
CH3COONa溶液加入少量水,溶液中 不变
不变
C. 向盐酸中加入氨水至中性,溶液中
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
A. 前2 min,D的平均反应速率为0.2 mol/(L·min)
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,平衡不移动
D. 增加B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子电池开始成为下一轮电池研究的重点,下图是一种可充电钠离子电池(电解质溶液为Na2SO3溶液) 工作时的示意图。下列说法正确的是
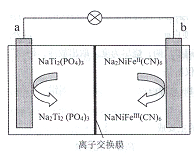
A. 电池放电时,Na+从a极区移动到b极区
B. 电池充电时,b极区发生的反应是:NaNiFeIII(CN)6+ e—+Na+=Na2NiFeII(CN)6
C. 金属钠可以作为该电池的负极材料
D. 若用该电池电解饱和食盐水,理论上每生成1molCl2,电池内有,1molNa+通过间子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某冶金厂的炉渣中主要成分为CuO、Cu、Ag、Bi、Pb,还含有少量的SiO2和Au,从炉渣中回收有价金属的一种工艺流程如下:
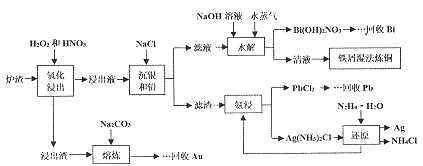
回答下列问题:
(1)加快“氧化浸出”速率的措施有________________。 (写出两种)。
(2)加入NaOH溶液的目的是调节滤液的pH,水解时通入水蒸气的目的是________。
(3)温法炼铜后溶液中主要的物质有(写化学式)____________。
(4)氨浸实验时,需要在常温下进行的原因是_________;熔炼时加入Na2CO3的目的是除硅,写出反应方程式____________。
(5)沉银和铅时,已知Ksp(AgCl)=1.8×10-10,Ksp(PbCl2)=1.8×10-5,当AgCl和PbCl2共沉且c(Pb2+):c(Ag+)=103时,溶液中的c(C1-)=______mol/L。
(6)写出流程中还原制银的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体应用与其性质的对应不正确的是( )
A.鉴别胶体与浊液(丁达尔效应)
B.高压除尘(电泳现象)
C.河海交汇处可沉积沙洲(聚沉)
D.喷雾剂的应用(布朗运动)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO3溶液显酸性,溶液中存在以下平衡:①HSO3-+ H2O![]() H2SO3+OH- ;②HSO3-
H2SO3+OH- ;②HSO3-![]() H++SO32-
H++SO32-
向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
A. 加入少量金属Na,平衡①左移,平衡②右移,溶液中[HSO3-]增大
B. 加入少量Na2SO3固体,则[H+]+[Na+]=[HSO3-]+[OH-]+![]() [SO32-]
[SO32-]
C. 加入少量NaOH溶液,  、
、 的值均增大
的值均增大
D. 加入氨水至中性,则2[Na+]=[SO32-]>[H+]=[OH-]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com