
分析 (1)强酸弱碱盐水解显酸性,水解生成挥发性酸时,加热蒸干并灼烧最终得到的是金属氧化物;
(2)醋酸和氢氧化钠溶液等体积等浓度混合时显碱性,则中性时物质的量浓度相同应使醋酸体积过量;
(3)醋酸是弱电解质,加水稀释有利于电离平衡正向移动,而盐酸是强电解质,不存在电离平衡,据此分析.
解答 解:(1)AlCl3属于强酸弱碱盐水解显酸性,其水解离子方程式表示为:Al3++3H2O?Al(OH)3+3H+,氯化铝水溶液在加热时水解生成Al(OH)3和HCl,HCl易挥发,灼烧得到Al2O3,
故答案为:酸; Al3++3H2O?Al(OH)3+3H+;Al2O3.
(2)若两者浓度相等时,则等体积混合时两者恰好完全反应得醋酸钠溶液,则溶液显碱性,故要想显中性,应使醋酸过量,即醋酸的浓度m>氢氧化钠的浓度n,故答案为:>;
(3)因为醋酸是弱酸,加水后反应正向进行,醋酸电离度增加,加水后,氢离子浓度在减小的过程中氢离子的物质的量增大,而盐酸是强酸在水中完全电离,加水后,氢离子浓度只是在减小,氢离子的物质的量不变,所以要使稀释后两溶液pH值相同,则醋酸的体积比盐酸的体积要大,就必须使m>n.故答案为:>.
点评 本题考查了稀释对强弱电解质的不同影响以及盐类水解的运用,应注意的是加水稀释,弱电解质的电离平衡会向右移动,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3→NO→NO2→HNO3 | B. | Al→Al2O3→Al(OH)3→NaAlO2 | ||
| C. | S→SO2→H2SO4→MgSO4 | D. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的结构简式:C2H4O2 | |
| B. | S2-的结构示意图: | |
| C. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | CO2的电子式${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{C}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应CaCO3(s)═CaO(s)+CO2(g)在常温下不能自发进行,则该反应的△H<0 | |
| B. | 0.lmol•L一1CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值减小 | |
| C. | 铅蓄电池在放电过程中,负极质量增加,正极质量减少 | |
| D. | 锅炉中沉积的CaSO4和BaSO4都可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中铁元素的化合价降低 | B. | 该反应属于分解反应 | ||
| C. | 该反应不属于置换反应 | D. | 该反应属于化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | Z | ||
| X | W |
| A. | 原子半径:X>Z>Y | B. | 气态氢化物的稳定性:X>Z | ||
| C. | Z、W均可与Mg形成离子化合物 | D. | 氧化物对应水化物的酸性:W>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
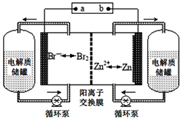 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A. | 阳离子交换膜可阻止Br2与Zn直接发生反应 | |
| B. | 放电时正极的电极反应式为Br2+2e-═2Br- | |
| C. | 充电时电极b连接电源的正极 | |
| D. | 放电时左侧电解质储罐中的离子总浓度增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com