
【题目】某无色溶液中可能含有Ba2+、Fe3+、Na+、K+、![]() 、
、![]() 、
、![]() 、Cl-、Br-、
、Cl-、Br-、![]() 中的若干种,离子浓度都为0.1mol/L,往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是( )
中的若干种,离子浓度都为0.1mol/L,往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是( )
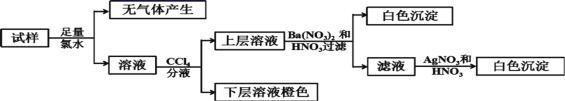
A.Ba2+、Fe3+、![]() 、
、![]() 肯定不存在,Na+、K+肯定存在
肯定不存在,Na+、K+肯定存在
B.原溶液肯定不含![]() 和
和![]()
C.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,对溶液中离子的判断有影响
D.是否含![]() 需另做实验判断
需另做实验判断
【答案】A
【解析】
溶液为无色,则一定不含Fe3+;往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成,则溶液中无SO42-;原溶液加足量氯水,无气体产生,则原溶液中无CO32-;流程中第二步加CCl4分液后下层为橙色,则溶液中必含Br-;上层溶液加Ba(NO3)2和HNO3后产生白色沉淀,且溶液中无SO42-,则溶液中含SO32-,则溶液无Ba2+;c(Br-)+2c(SO32-)=0.1mol/L+2×0.1mol/L=0.3mol/L,因为离子浓度都为0.1mol/L,则结合电荷守恒必有Na+、K+、![]() 且无c(Cl-),综上所述,一定含有Na+、K+、
且无c(Cl-),综上所述,一定含有Na+、K+、![]() 、Br-、SO32-,一定不含Ba2+、Fe3+、
、Br-、SO32-,一定不含Ba2+、Fe3+、![]() 、
、![]() 、Cl-,据此解答。
、Cl-,据此解答。
A.由分析可知,Ba2+、Fe3+、![]() 、
、![]() 肯定不存在,Na+、K+肯定存在,A正确;
肯定不存在,Na+、K+肯定存在,A正确;
B.溶液中一定含SO32-,B错误;
C.因流程中第一步加了足量氯水,所以溶液中的SO32-在第一步就已经被氧化成SO42-,步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,对溶液中离子的判断无影响,C错误;
D.因离子浓度都为0.1mol/L,根据电荷守恒有:0.3mol/L=c(Br-)+2c(SO32-)=c(Na+)+c(K+)+ c(NH4+),溶液中一定含NH4+,D错误。
答案选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】中国科学家创造性地构建了硅化物晶格限域的单铁中心催化剂,成功地实现了甲烷在无氧条件下选择活化,一步高效生产乙烯、芳烃和氢气等化学品。请回答下列问题:
(1)基态铁原子的价层电子轨道表达式为______。
(2)硅、碳位于同一主族,用“![]() ”“
”“![]() ”或“
”或“![]() ”填空:
”填空:
性质 | 原子半径 | 第一电离能 | 熔点 | 键能 |
项目 |
|
|
|
|
(3)CN-能与Fe3+形成配合物,与CN-互为等电子体的分子有______ (任写一种);1 mol[Fe(CN)6 ]3-中含______molσ键。
(4)已知:反应![]() ,碳原子的杂化类型转化过程为______;
,碳原子的杂化类型转化过程为______;
从共价键重叠方式看,![]() 分子中
分子中![]() 键类型为;
键类型为;![]() 的键角比
的键角比![]() 的键角______
的键角______![]() 填“大”或“小”
填“大”或“小”![]() 。
。
(5)晶体有两种晶胞,如图1、图2所示。

图1中晶胞中铁的配位数为______;图2中铁晶胞堆积方式为______。
(6)碳化硅晶胞如图3所示,已知碳化硅晶体的密度为dgcm-3,NA表示阿伏加德罗常数的值,则碳化硅中硅碳键的键长为______ pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热的恒容密闭容器中,可逆反应![]() 达到平衡状态的标志是( )
达到平衡状态的标志是( )
①![]() ②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥
②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥![]() ⑦3mol H-H键断裂的同时有2mol N-H键也断裂
⑦3mol H-H键断裂的同时有2mol N-H键也断裂
A.①②③⑤⑥B.②③④⑤⑥
C.②③⑤⑥D.②③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在2L的密闭容器中进行如下可逆反应,各物质的有关数据如下:
aA(g) |
| bB(g) |
| 2C(g) | |
起始物质的量浓度/(mol·L-1): | 1.5 | 1 | 0 | ||
2s末物质的量浓度/(mol·L-1): | 0.9 | 0.8 | 0.4 |
请回答下列问题。
①该可逆反应的化学方程式可表示为__。
②用物质B来表示0~2s的平均反应速率为__。
③从反应开始到2s末,A的转化率为__。
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是__(填序号)
A.vB(消耗)=vC(生成)
B.容器内气体的总压强保持不变
C.容器内气体的密度不变
D.vA:vB:vC=3:1:2
E.容器内气体C的物质的量分数保持不变
(2)①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应方程式是2Zn+O2=2ZnO。则该电池的负极材料是__。
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池的示意图如图,该燃料电池工作时,电池的总反应方程式为__;负极的电极反应式为__。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁是常见的水处理剂。某氯化铁(FeCl36H2O)样品含有少量FeCl2杂质。现要测定其中FeCl36H2O的质量分数,实验按以下步骤进行:
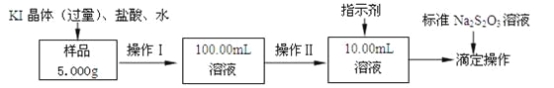
已知有关离子方程式为:2Fe3++2I-═2Fe2++I2,I2+2S2O32-═2I-+S4O62-
(1)取少量氯化铁样品滴入50mL沸水中,加热片刻,液体呈现红褐色,反应的离子方程式为:________________________。
(2)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、_________(填仪器名称)。
(3)操作II必须用到的仪器是________(选填编号);
a.50mL烧杯 b.10mL量筒 c.20mL量筒 d.25mL滴定管
指示剂是淀粉溶液,则达到滴定终点的现象是__________________________。
(4)滴定时,消耗浓度为0.1000mol/L的标准Na2S2O3溶液18.00mL。该样品中FeCl36H2O(式量为270.5)的质量分数为_____________。
(5)要把样品氯化铁中的少量FeCl2杂质除去,可用的试剂是________(选填编号)。
a.铁粉 b.氯水 c.溴水 d.双氧水
(6)如果采用以下步骤测定氯化铁样品元素的含量,完成下列填空。
①称量样品 ②加水溶解 ③加足量氨水,沉淀 ④过滤 ⑤灼烧 ⑥称量并进行恒重操作。
还缺少的一步操作是________;在过滤前,需要检验是否沉淀完全,其操作___________________;判断是否恒重的标准是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如图所示:
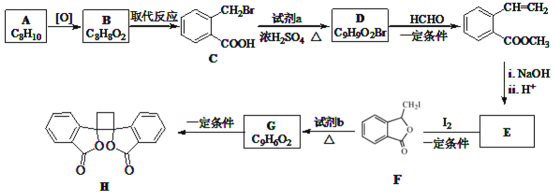
已知:
![]()
![]() R—HC=CH—R’
R—HC=CH—R’
ii.R—HC=CH—R’![]()
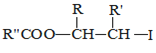
iii.R—HC=CH—R’![]()
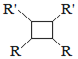
![]() 以上R、
以上R、![]() 、
、![]() 代表氢、烷基或芳基等
代表氢、烷基或芳基等![]()
![]() 属于芳香烃,其名称是______。
属于芳香烃,其名称是______。
![]() 的结构简式是______。
的结构简式是______。
![]() 由F生成G的反应类型是______。
由F生成G的反应类型是______。
![]() 由E与
由E与![]() 在一定条件下反应生成F的化学方程式是______;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是______。
在一定条件下反应生成F的化学方程式是______;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是______。
![]() 下列说法正确的是______
下列说法正确的是______![]() 选填字母序号
选填字母序号![]() 。
。
A.G存在顺反异构体
B.由G生成H的反应是加成反应
C.1molG最多可以与1mol![]() 发生加成反应
发生加成反应
D.1molF或1molH与足量NaOH溶液反应,均消耗2molNaOH
![]() 以乙烯为起始原料,结合已知信息选用必要的无机试剂合成
以乙烯为起始原料,结合已知信息选用必要的无机试剂合成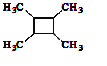 ,写出合成路线
,写出合成路线![]() 用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件
用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件![]() 。______。
。______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是( )
A. 沸点:戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷
B. 密度:CCl4>CHCl3>H2O>苯
C. 含氢质量分数:甲烷>乙烷>乙烯>乙炔>苯
D. 等质量的物质燃烧耗O2量:苯>乙烷>乙烯>甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是
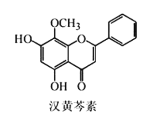
A.汉黄芩素的分子式为C16H13O5
B.该物质能与Na2CO3溶液反应,遇FeCl3溶液显色
C.1mol该物质与溴水反应最多可与2molBr2发生加成反应
D.该分子最多能与6molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数。
(1)在CB3分子中C元素原子的原子轨道发生的是____杂化,CB3分子的空间构型为____。
(2)C的氢化物极易溶于水的原因是____。
(3)D元素与同周期相邻元素的第一电离能由大到小的关系是:____(用元素符号表示);
(4)氧原子的价层电子的轨道表示式为____。
(5)X与Y所形成化合物晶体的晶胞如图所示。
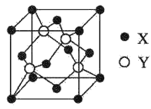
①在一个晶胞中,X离子的数目为____;
②若该化合物的密度为ag·cm-3,则晶胞的体积是____cm3(只要求列出计算式,阿伏加德罗常数用NA表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com