
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数。
(1)在CB3分子中C元素原子的原子轨道发生的是____杂化,CB3分子的空间构型为____。
(2)C的氢化物极易溶于水的原因是____。
(3)D元素与同周期相邻元素的第一电离能由大到小的关系是:____(用元素符号表示);
(4)氧原子的价层电子的轨道表示式为____。
(5)X与Y所形成化合物晶体的晶胞如图所示。
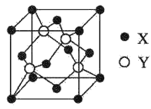
①在一个晶胞中,X离子的数目为____;
②若该化合物的密度为ag·cm-3,则晶胞的体积是____cm3(只要求列出计算式,阿伏加德罗常数用NA表示)。
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Ba2+、Fe3+、Na+、K+、![]() 、
、![]() 、
、![]() 、Cl-、Br-、
、Cl-、Br-、![]() 中的若干种,离子浓度都为0.1mol/L,往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是( )
中的若干种,离子浓度都为0.1mol/L,往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是( )
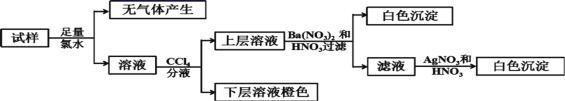
A.Ba2+、Fe3+、![]() 、
、![]() 肯定不存在,Na+、K+肯定存在
肯定不存在,Na+、K+肯定存在
B.原溶液肯定不含![]() 和
和![]()
C.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,对溶液中离子的判断有影响
D.是否含![]() 需另做实验判断
需另做实验判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学设计了如图装置制取溴苯和溴乙烷:
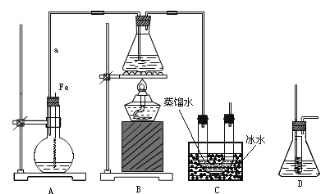
已知:乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下 表所示:
溶解性(本身均可作溶剂) | 沸点(℃) | 密度(g/mL) | |
乙醇 | 与水互溶,易溶于有机溶剂 | 78.5 | 0.8 |
溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
请回答下列问题:
(1)B中发生反应生成目标产物的化学方程式为______。
(2)导管a的作用是______。
(3)反应完毕后,U形管内的现象是______;分离溴乙烷时所需的玻璃仪器是______。
(4)简述实验中用纯铁丝代替铁粉的优点:______。
(5)实验完成后,某同学在溴乙烷中加入NaOH乙醇溶液并加热,为判断其发生的是水解 反应还是消去反应,该同学设计了甲、乙两个方案:
方案甲:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应
方案乙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则证明发生了消去反应。
则有关上述实验方案的叙述(_____)
A 方案甲正确 B 方案乙正确 C 两个方案都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是
A.0.1 mol·L-1NaHSO4溶液中:c(Na+)>c(SO42-)>c(H+) >c(OH-)
B.0.1 mol·L-1Na2S溶液中:2 c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:C(Na+)=c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核黄素又称为维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳。核黄素分子的结构为:

已知:
有关核黄素的下列说法中,不正确的是:
A.该化合物的分子式为C17H22N4O6
B.酸性条件下加热水解,有CO2生成
C.酸性条件下加热水解,所得溶液加碱后有NH3生成
D.能发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾![]() 是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿
是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿![]() 主要成分为
主要成分为![]() 为原料生产高锰酸钾的工艺路线如下:
为原料生产高锰酸钾的工艺路线如下:
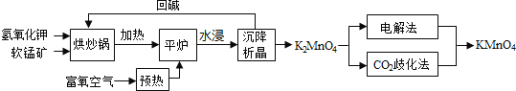
回答下列问题:
![]() 原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 __________________________________________;
原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 __________________________________________;
![]() “平炉”中发生的化学方程式为 _______________________________;
“平炉”中发生的化学方程式为 _______________________________;
![]() “平炉”中需要加压,其目的是 _______________________________;
“平炉”中需要加压,其目的是 _______________________________;
![]() 将
将![]() 转化为
转化为![]() 的生产有两种工艺:
的生产有两种工艺:
![]() “
“![]() 歧化法”是传统工艺,即在
歧化法”是传统工艺,即在![]() 溶液中通入
溶液中通入![]() 气体,使体系呈中性或弱酸性,
气体,使体系呈中性或弱酸性,![]() 发生歧化反应,反应中生成
发生歧化反应,反应中生成![]() ,
,![]() 和 __________________
和 __________________![]() 写化学式
写化学式![]() ;
;
![]() “电解法”为现代工艺,即电解
“电解法”为现代工艺,即电解![]() 水溶液,电解槽中阳极发生的电极反应为______________________________________________;
水溶液,电解槽中阳极发生的电极反应为______________________________________________;
![]() “电解法”和“
“电解法”和“![]() 歧化法”中,
歧化法”中,![]() 的理论利用率之比为______;
的理论利用率之比为______;
![]() 高锰酸钾纯度的测定:称取
高锰酸钾纯度的测定:称取![]() 样品,溶解后定容于100mL容量瓶中,摇匀。取浓度为
样品,溶解后定容于100mL容量瓶中,摇匀。取浓度为![]() 的
的![]() 标准溶液
标准溶液![]() ,加入稀硫酸酸化,用
,加入稀硫酸酸化,用![]() 溶液平行滴定三次,平均消耗的体积为
溶液平行滴定三次,平均消耗的体积为![]() ,该样品的纯度为_____________
,该样品的纯度为_____________![]() 列出计算式即可,已知
列出计算式即可,已知![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界存在的元素中,金属元素种类更多,非金属元素丰度更大。
Ⅰ.80%左右的非金属元素在现代技术包括能源、功能材料等领域占有极为重要的地位。
(1)氮及其化合物与人类生产、生活息息相关,基态N原子的价电子排布图是_____________,N2F2分子中N原子的杂化方式是_______,1 mol N2F2含有________个σ键。
(2)高温陶瓷材料Si3N4晶体中键角N-Si-N____(填“>”、“<”或“=”)Si-N-Si,原因_________。
Ⅱ.金属元素在现代工业中也占据极其重要的地位。其中钛也被称为“未来的钢铁”,具有质轻、抗腐蚀、硬度大,是宇航、航海、化工设备等的理想材料,是一种重要的战略资源,越来越受到各国的重视。
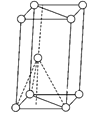
(3)基态钛原子核外共有________种运动状态不相同的电子。金属钛晶胞如下图所示,为________(填堆积方式)堆积。
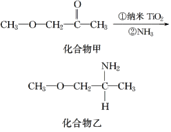
(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图。化合物乙的沸点明显高于化合物甲,主要原因是__________。化合物乙中采取sp3杂化的原子的电负性由大到小的顺序为__________________。
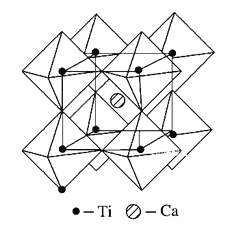
(5)钙钛矿晶体的结构如图所示。假设把氧离子看作硬球接触模型,钙离子和钛离子填充氧离子的空隙,氧离子形成正八面体,钛离子位于正八面体中心,钙离子位于立方晶胞的体心,一个钙离子被________个氧离子包围。钙钛矿晶体的化学式为________。若氧离子半径为a pm,则钙钛矿晶体中两个钛离子间最短距离为_______pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等离子.向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如右图所示.下列有关判断正确的是
等离子.向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如右图所示.下列有关判断正确的是![]()
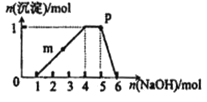
A.m点处反应:![]()
B.p点:![]()
C.若取原溶液做焰色反应实验,焰色应为黄色
D.原溶液中存在的主要离子:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组在网上收集到如下信息:以贫软锰矿和有色金属冶炼厂的![]() 废气为原料制备高纯碳酸锰.已知,贫软锰矿的主要成分为
废气为原料制备高纯碳酸锰.已知,贫软锰矿的主要成分为![]() 和少量
和少量![]() 、
、![]() 、
、![]() 等杂质.工艺流程如图1:
等杂质.工艺流程如图1:

已知:有关氢氧化物沉淀pH对应表
物质 | 开始沉淀时的pH | 完全沉淀时的pH |
氢氧化铁 |
|
|
氢氧化铝 |
|
|
氢氧化亚铁 |
|
|
请回答:
![]() 在浸出液除杂过程中需通入适量空气并调节溶液的pH到
在浸出液除杂过程中需通入适量空气并调节溶液的pH到![]() ,沉淀部分杂质离子,此时滤渣I中主要含有 ______
,沉淀部分杂质离子,此时滤渣I中主要含有 ______ ![]() 填化学式
填化学式![]() .
.
![]() 影响浸锰率的操作因素有多种,其中温度选择不合理时会产生杂质
影响浸锰率的操作因素有多种,其中温度选择不合理时会产生杂质![]() 造成锰损失.温度对浸锰率的影响见图2、图3.
造成锰损失.温度对浸锰率的影响见图2、图3.
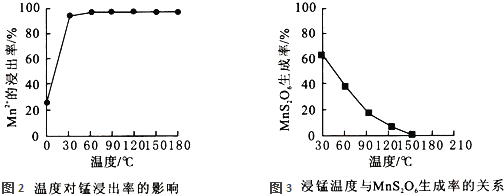
为了提高锰的浸出率,请选择合适的条件 ______ ![]() 填序号
填序号![]()
![]() 以上
以上
![]() 在滤液中加入
在滤液中加入![]() 生成
生成![]() 的同时还可以获得一种作为肥料的副产物,写出该过程的化学反应方程式 ______ ,从废液中分离出该副产物的操作是蒸发浓缩、 ______
的同时还可以获得一种作为肥料的副产物,写出该过程的化学反应方程式 ______ ,从废液中分离出该副产物的操作是蒸发浓缩、 ______ ![]() 若该分离过程在实验室进行,其中除了需要酒精灯、蒸发皿、玻璃棒外,还需要 ______ .
若该分离过程在实验室进行,其中除了需要酒精灯、蒸发皿、玻璃棒外,还需要 ______ .
![]() 现有含锰质量分数为
现有含锰质量分数为![]() 的贫锰矿1吨,若按照上述工艺锰的产率为
的贫锰矿1吨,若按照上述工艺锰的产率为![]() ,最终获得碳酸锰的质量 ______ .
,最终获得碳酸锰的质量 ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com