
【题目】自然界存在的元素中,金属元素种类更多,非金属元素丰度更大。
Ⅰ.80%左右的非金属元素在现代技术包括能源、功能材料等领域占有极为重要的地位。
(1)氮及其化合物与人类生产、生活息息相关,基态N原子的价电子排布图是_____________,N2F2分子中N原子的杂化方式是_______,1 mol N2F2含有________个σ键。
(2)高温陶瓷材料Si3N4晶体中键角N-Si-N____(填“>”、“<”或“=”)Si-N-Si,原因_________。
Ⅱ.金属元素在现代工业中也占据极其重要的地位。其中钛也被称为“未来的钢铁”,具有质轻、抗腐蚀、硬度大,是宇航、航海、化工设备等的理想材料,是一种重要的战略资源,越来越受到各国的重视。
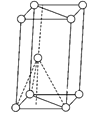
(3)基态钛原子核外共有________种运动状态不相同的电子。金属钛晶胞如下图所示,为________(填堆积方式)堆积。
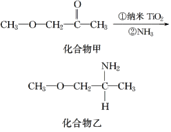
(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图。化合物乙的沸点明显高于化合物甲,主要原因是__________。化合物乙中采取sp3杂化的原子的电负性由大到小的顺序为__________________。
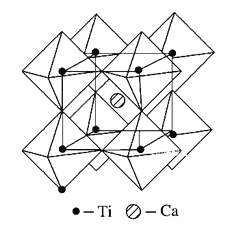
(5)钙钛矿晶体的结构如图所示。假设把氧离子看作硬球接触模型,钙离子和钛离子填充氧离子的空隙,氧离子形成正八面体,钛离子位于正八面体中心,钙离子位于立方晶胞的体心,一个钙离子被________个氧离子包围。钙钛矿晶体的化学式为________。若氧离子半径为a pm,则钙钛矿晶体中两个钛离子间最短距离为_______pm。
【答案】![]() sp2 1.806×1024 > Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N-Si-N。键角为109°28′,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大,使得Si-N-Si键角小于109°28′ 22 六方最密 化合物乙形成分子间氢键 O>N>C 12 CaTiO3
sp2 1.806×1024 > Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N-Si-N。键角为109°28′,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大,使得Si-N-Si键角小于109°28′ 22 六方最密 化合物乙形成分子间氢键 O>N>C 12 CaTiO3 ![]() a
a
【解析】
Ⅰ.(1)根据构造原理书写基态N原子的价电子排布式,然后根据同一电子层各个轨道电子尽可能成单排列,而且自旋方向相同书写电子排布图,N2F2分子中N原子之间形成N=N双键,N原子与F原子之间形成N-F键,N原子含有1对孤对电子;
(2)Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大;
II.(3)在任何一种核外电子没有运动状态完全相同的电子;根据金属钛晶胞结构分析其所属金属晶体类型堆积方式;
(4)化合物甲与化合物乙均为分子晶体,但化合物乙分子间可形成氢键;化合物乙中C、N、O三种原子的杂化轨道形成均为sp3,根据同一周期元素电负性变化规律分析判断;
(5)钛晶矿晶胞中钛离子与周围六个氧原子包围形成八面体,立方体晶胞共有12个边长,每条边长的中点是一个氧原子,共12个氧原子包围着中心的钙离子,根据均摊法计算图中立方体中各原子数目确定化学式;若氧离子半径为a pm,则正八面体的棱长为2a pm,则2个正四面体的连接面为正方形,该正方形棱长为2apm,Ti位于正方形的中心,两个钛离子间最短距离等于正方形对角线长度。
Ⅰ.(1)N是7号元素,根据构造原理可知基态N原子的核外电子排布式是1s22s22p3,其基态价电子排布式是2s22p3,在2p亚层上有3个轨道,由于电子尽可能成单排列,而且自旋方向相同,所以N基态价电子排布图为:![]() ;N2F2分子结构式为F-N=N-F,分子中N原子含有1对孤对电子,N原子的杂化方式是sp2杂化,lmol N2F2含有3molσ键,即1.806×1024个σ键;
;N2F2分子结构式为F-N=N-F,分子中N原子含有1对孤对电子,N原子的杂化方式是sp2杂化,lmol N2F2含有3molσ键,即1.806×1024个σ键;
(2)Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N-Si-N键角为109°28′;N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大,使得Si-N-Si键角小于109°28′;
II.(3)Ti原子核外有22个电子,则Ti原子核外共有22种运动状态不同的电子;由金属钛晶胞结构可知,金属钛属于六方最密堆积;
(4)化合物甲只存在分子间作用力,而化合物乙除存在分子间作用力外,还存在氢键,增加了分子之间的吸引力,因此化合物乙的沸点比化合物甲高,在化合物乙中C、N、O三种原子的杂化轨道均为sp3杂化,这三种元素位于同一周期,由于同一周期元素从左到右元素的电负性逐渐增大,所以三种元素的电负性:O>N>C;
(5)钛离子位于立方晶胞的角顶,被6个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被12个氧离子包围,一个钙离子周围离Ca2+距离最近且相等的O2-有12个,分别位于晶胞的12个棱中心,故一个钙离子被12个氧离子包围;在该晶胞中含有Ca2+数目为1个,含有Ti原子数为8×![]() =1,含有的O2-数目为12×
=1,含有的O2-数目为12×![]() =3,所以该晶体化学式为CaTiO3;
=3,所以该晶体化学式为CaTiO3;
若O2-半径为a pm,则正八面体的棱长为2a pm,则2个正四面体的连接面为正方形,该正方形棱长为2apm,Ti位于正方形的中心,两个钛离子间最短距离正方形对角线长度,故两个钛离子间最短距离为![]() apm。
apm。


科目:高中化学 来源: 题型:
【题目】下列关系正确的是( )
A. 沸点:戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷
B. 密度:CCl4>CHCl3>H2O>苯
C. 含氢质量分数:甲烷>乙烷>乙烯>乙炔>苯
D. 等质量的物质燃烧耗O2量:苯>乙烷>乙烯>甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含锂废渣(主要金属元素的含量:Li 3.50% Ni 6.55% Ca 6.41% Mg 13.24%)制备Li2CO3,并用其制备锂电池的正极材料LiFePO4。部分工艺流程如下:
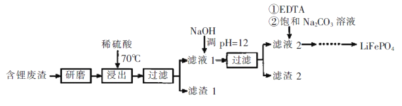
资料:i滤液1、滤液2中部分例子浓度(g·L-1)
Li+ | Ni2+ | Ca2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 0.36 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.08 | 0.78×10-3 |
ii.EDTA能和某些二价金属离子形成稳定的水溶性络合物
iii.某些物质的溶解度(S)
T/℃ | 20 | 40 | 60 | 80 | 100 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
S(Li2SO4)/g | 34.7 | 33.6 | 32.7 | 31.7 | 30.9 |
I.制备Li2CO3粗品
(1)上述流程中为加快化学反应速率而采取的措施是____。
(2)滤渣2的主要成分有____。
(3)向滤液2中先加入EDTA,再加入饱和Na2C03溶液,90℃充分反应后,分离出固体 Li2CO3粗品的操作是_______。
(4)处理lkg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是________g。(摩尔质量:Li2CO3 74 g.mol4)
II.纯化Li2CO3粗品
(5)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO31溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是____,该池使用了_________(填“阳”或“阴”)离子交换膜。
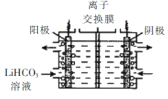
Ⅲ.制备 LiFePO4
(6)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数。
(1)在CB3分子中C元素原子的原子轨道发生的是____杂化,CB3分子的空间构型为____。
(2)C的氢化物极易溶于水的原因是____。
(3)D元素与同周期相邻元素的第一电离能由大到小的关系是:____(用元素符号表示);
(4)氧原子的价层电子的轨道表示式为____。
(5)X与Y所形成化合物晶体的晶胞如图所示。
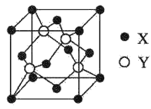
①在一个晶胞中,X离子的数目为____;
②若该化合物的密度为ag·cm-3,则晶胞的体积是____cm3(只要求列出计算式,阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。
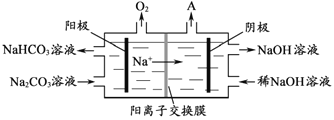
(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题。

(1)化学反应速率本质上是由_____________ 决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3表明_____________ 对反应速率有影响,该因素对反应速率的具体影响是其他条件相同时,_____________反应速率越快。
(2)我们选取实验_____________(填实验序号)研究锌的形状对反应速率的影响。我们发现在其他条件相同时,反应物间的_____________反应速率越快。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少硫酸铜溶液,发现反应速率明显加快,原因是 _____________。
(4)利用表中数据,可以求出硫酸的物质的量浓度是_____________![]() (计算结果精确到小数点后一位)。
(计算结果精确到小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列8种与人们生产生活相关的有机物:① HCHO(防腐剂)② CH3CH2CHO(化工原料)③CH3CH2CH2CH3(打火机燃料)④ ![]() (冷冻剂)⑤
(冷冻剂)⑤ ![]() (汽车防冻液)⑥
(汽车防冻液)⑥ ![]() (杀菌剂)⑦
(杀菌剂)⑦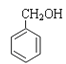 (定香剂)⑧
(定香剂)⑧ ![]() (汽油添加剂)请回答:
(汽油添加剂)请回答:
(1)属于醇的是____(填序号,下同)。
(2)互为同系物的是_____。
(3)互为同分异构体的是__。
(4)用系统命名法给④命名,其名称为_____。
(5)写出②与银氨溶液发生银镜反应的化学方程式__。
(6)写出⑧与浓硝酸反应生成TNT的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的说法正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(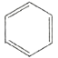 )看,78g苯中含有碳碳双键数为3NA
)看,78g苯中含有碳碳双键数为3NA
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的化学键完全相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com