
【题目】控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题。

(1)化学反应速率本质上是由_____________ 决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3表明_____________ 对反应速率有影响,该因素对反应速率的具体影响是其他条件相同时,_____________反应速率越快。
(2)我们选取实验_____________(填实验序号)研究锌的形状对反应速率的影响。我们发现在其他条件相同时,反应物间的_____________反应速率越快。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少硫酸铜溶液,发现反应速率明显加快,原因是 _____________。
(4)利用表中数据,可以求出硫酸的物质的量浓度是_____________![]() (计算结果精确到小数点后一位)。
(计算结果精确到小数点后一位)。
【答案】反应物本身的性质 温度 温度越高 1、2和4 接触面积越大 锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率 2.0
【解析】
(1)化学反应速率本质上是由反应物本身的性质决定的;实验2和实验3中,除了温度不同外,其他条件完全相同,则说明探究的是温度对反应速率的影响,即温度越高反应速率越快;
(2)根据表中数据可知,实验1、2和4中,除了锌的形状不同外,其他条件完全相同,则它们是探究锌的形状对反应速率的影响,即反应物间的接触面积越大反应速率越快;
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,由于锌会置换出少量的金属铜,在该条件下构成了原电池,所以反应速率明显加快;
(4)根据实验6和实验7可知,加入8.0g锌与加入10.0g锌生成的硫酸锌质量相同,说明两个实验中硫酸完全反应,16.1g硫酸锌的物质的量为![]() ,则原硫酸的物质的量浓度为
,则原硫酸的物质的量浓度为![]() 。
。


科目:高中化学 来源: 题型:
【题目】把4.48 LCO2通过一定量的固体过氧化钠后收集到3.36L气体(标况下),则这3.36L气体的质量是( )
A.3.8gB.4.8gC.5.6gD.6.0g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是
A.0.1 mol·L-1NaHSO4溶液中:c(Na+)>c(SO42-)>c(H+) >c(OH-)
B.0.1 mol·L-1Na2S溶液中:2 c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:C(Na+)=c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾![]() 是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿
是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿![]() 主要成分为
主要成分为![]() 为原料生产高锰酸钾的工艺路线如下:
为原料生产高锰酸钾的工艺路线如下:
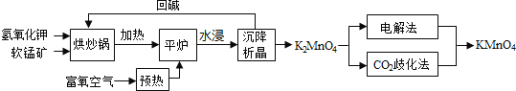
回答下列问题:
![]() 原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 __________________________________________;
原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 __________________________________________;
![]() “平炉”中发生的化学方程式为 _______________________________;
“平炉”中发生的化学方程式为 _______________________________;
![]() “平炉”中需要加压,其目的是 _______________________________;
“平炉”中需要加压,其目的是 _______________________________;
![]() 将
将![]() 转化为
转化为![]() 的生产有两种工艺:
的生产有两种工艺:
![]() “
“![]() 歧化法”是传统工艺,即在
歧化法”是传统工艺,即在![]() 溶液中通入
溶液中通入![]() 气体,使体系呈中性或弱酸性,
气体,使体系呈中性或弱酸性,![]() 发生歧化反应,反应中生成
发生歧化反应,反应中生成![]() ,
,![]() 和 __________________
和 __________________![]() 写化学式
写化学式![]() ;
;
![]() “电解法”为现代工艺,即电解
“电解法”为现代工艺,即电解![]() 水溶液,电解槽中阳极发生的电极反应为______________________________________________;
水溶液,电解槽中阳极发生的电极反应为______________________________________________;
![]() “电解法”和“
“电解法”和“![]() 歧化法”中,
歧化法”中,![]() 的理论利用率之比为______;
的理论利用率之比为______;
![]() 高锰酸钾纯度的测定:称取
高锰酸钾纯度的测定:称取![]() 样品,溶解后定容于100mL容量瓶中,摇匀。取浓度为
样品,溶解后定容于100mL容量瓶中,摇匀。取浓度为![]() 的
的![]() 标准溶液
标准溶液![]() ,加入稀硫酸酸化,用
,加入稀硫酸酸化,用![]() 溶液平行滴定三次,平均消耗的体积为
溶液平行滴定三次,平均消耗的体积为![]() ,该样品的纯度为_____________
,该样品的纯度为_____________![]() 列出计算式即可,已知
列出计算式即可,已知![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界存在的元素中,金属元素种类更多,非金属元素丰度更大。
Ⅰ.80%左右的非金属元素在现代技术包括能源、功能材料等领域占有极为重要的地位。
(1)氮及其化合物与人类生产、生活息息相关,基态N原子的价电子排布图是_____________,N2F2分子中N原子的杂化方式是_______,1 mol N2F2含有________个σ键。
(2)高温陶瓷材料Si3N4晶体中键角N-Si-N____(填“>”、“<”或“=”)Si-N-Si,原因_________。
Ⅱ.金属元素在现代工业中也占据极其重要的地位。其中钛也被称为“未来的钢铁”,具有质轻、抗腐蚀、硬度大,是宇航、航海、化工设备等的理想材料,是一种重要的战略资源,越来越受到各国的重视。
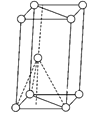
(3)基态钛原子核外共有________种运动状态不相同的电子。金属钛晶胞如下图所示,为________(填堆积方式)堆积。
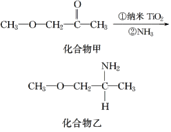
(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图。化合物乙的沸点明显高于化合物甲,主要原因是__________。化合物乙中采取sp3杂化的原子的电负性由大到小的顺序为__________________。
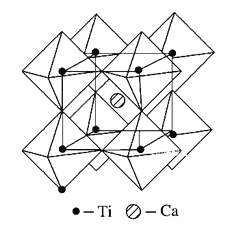
(5)钙钛矿晶体的结构如图所示。假设把氧离子看作硬球接触模型,钙离子和钛离子填充氧离子的空隙,氧离子形成正八面体,钛离子位于正八面体中心,钙离子位于立方晶胞的体心,一个钙离子被________个氧离子包围。钙钛矿晶体的化学式为________。若氧离子半径为a pm,则钙钛矿晶体中两个钛离子间最短距离为_______pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下将40g已磨成粉末的![]() 和
和![]() 置于250mL锥形瓶中,迅速搅拌使固体药品混合均匀,再在玻璃管口悬挂一块湿润的红色石蕊试纸(如图所示)。请回答下列问题:
置于250mL锥形瓶中,迅速搅拌使固体药品混合均匀,再在玻璃管口悬挂一块湿润的红色石蕊试纸(如图所示)。请回答下列问题:
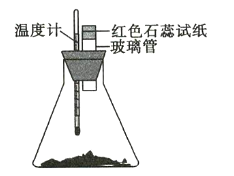
(1)湿润的红色石蕊试纸发生的变化是_________________,其原因是_______。
(2)温度计的变化是_______________________,其原因是_______________________ 。
(3)锥形瓶中发生反应的化学方程式为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等离子.向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如右图所示.下列有关判断正确的是
等离子.向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如右图所示.下列有关判断正确的是![]()
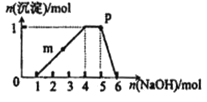
A.m点处反应:![]()
B.p点:![]()
C.若取原溶液做焰色反应实验,焰色应为黄色
D.原溶液中存在的主要离子:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物有如下转化关系:
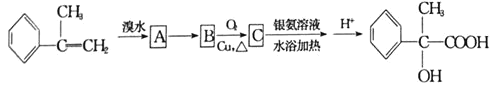
(1)写出反应![]() 的反应条件是________,C中官能团的结构简式是________________。
的反应条件是________,C中官能团的结构简式是________________。
(2)反应![]() 的反应类型为________________________。
的反应类型为________________________。
(3)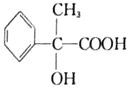 在浓硫酸加热条件下可以生成含有三个六元环结构的环酯,该有机物结构简式为:________________。
在浓硫酸加热条件下可以生成含有三个六元环结构的环酯,该有机物结构简式为:________________。
(4)任意写出一种符合下列条件的C的同分异构体的结构简式:________________。
①属于芳香族化合物,苯环上有两个取代基
②与碳酸氢钠溶液反应放出二氧化碳气体
③苯环上的一氯代物有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成分是MgO,还有CaO、MnO、![]() 、FeO、
、FeO、![]() ,、
,、![]() 等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业.从硼镁泥中制取
等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业.从硼镁泥中制取![]() 的工艺流程如下:
的工艺流程如下:
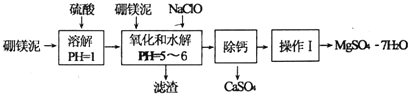
已知:NaClO与![]() 反应产生
反应产生![]() 沉淀.
沉淀.
沉淀物 |
|
|
|
开始沉淀pH |
|
|
|
完全沉淀pH |
|
|
|
![]() 实验中需用
实验中需用![]() 的硫酸
的硫酸![]() 若用
若用![]() 的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有 ______ .
的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有 ______ .
![]() 滤渣的主要成分除含有
滤渣的主要成分除含有![]() 、
、![]() 外,还有 ______ .
外,还有 ______ .
![]() “操作I”的主要操作为蒸发浓缩、冷却结晶、 ______ .
“操作I”的主要操作为蒸发浓缩、冷却结晶、 ______ .
![]() 写出加入NaClO时,溶液中氧化还原反应的离子方程式 ______ 、 ______ .
写出加入NaClO时,溶液中氧化还原反应的离子方程式 ______ 、 ______ .
![]() 已知:溶液的
已知:溶液的![]() 时,铝元素有多种存在形态,如
时,铝元素有多种存在形态,如![]() 、
、![]() 、
、![]() 等,各形态之间可相互转化,写出该溶液中
等,各形态之间可相互转化,写出该溶液中![]() 转化为
转化为![]() 的离子方程式 ______ ;
的离子方程式 ______ ;
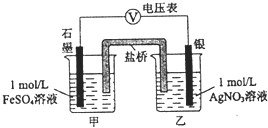
![]() 某同学为探究
某同学为探究![]() 和
和![]() 反应,按如图连接装置并加入药品
反应,按如图连接装置并加入药品![]() 盐桥中的物质不参与反应
盐桥中的物质不参与反应![]() ,发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓
,发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓![]() 溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为 ______ 极
溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为 ______ 极![]() 填“正”或“负”
填“正”或“负”![]() 由实验得出
由实验得出![]() 和
和![]() 反应的离子方程式是 ______
反应的离子方程式是 ______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com