
【题目】高锰酸钾![]() 是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿
是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿![]() 主要成分为
主要成分为![]() 为原料生产高锰酸钾的工艺路线如下:
为原料生产高锰酸钾的工艺路线如下:
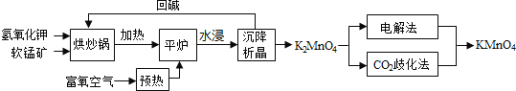
回答下列问题:
![]() 原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 __________________________________________;
原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 __________________________________________;
![]() “平炉”中发生的化学方程式为 _______________________________;
“平炉”中发生的化学方程式为 _______________________________;
![]() “平炉”中需要加压,其目的是 _______________________________;
“平炉”中需要加压,其目的是 _______________________________;
![]() 将
将![]() 转化为
转化为![]() 的生产有两种工艺:
的生产有两种工艺:
![]() “
“![]() 歧化法”是传统工艺,即在
歧化法”是传统工艺,即在![]() 溶液中通入
溶液中通入![]() 气体,使体系呈中性或弱酸性,
气体,使体系呈中性或弱酸性,![]() 发生歧化反应,反应中生成
发生歧化反应,反应中生成![]() ,
,![]() 和 __________________
和 __________________![]() 写化学式
写化学式![]() ;
;
![]() “电解法”为现代工艺,即电解
“电解法”为现代工艺,即电解![]() 水溶液,电解槽中阳极发生的电极反应为______________________________________________;
水溶液,电解槽中阳极发生的电极反应为______________________________________________;
![]() “电解法”和“
“电解法”和“![]() 歧化法”中,
歧化法”中,![]() 的理论利用率之比为______;
的理论利用率之比为______;
![]() 高锰酸钾纯度的测定:称取
高锰酸钾纯度的测定:称取![]() 样品,溶解后定容于100mL容量瓶中,摇匀。取浓度为
样品,溶解后定容于100mL容量瓶中,摇匀。取浓度为![]() 的
的![]() 标准溶液
标准溶液![]() ,加入稀硫酸酸化,用
,加入稀硫酸酸化,用![]() 溶液平行滴定三次,平均消耗的体积为
溶液平行滴定三次,平均消耗的体积为![]() ,该样品的纯度为_____________
,该样品的纯度为_____________![]() 列出计算式即可,已知
列出计算式即可,已知![]() 。
。
【答案】增大反应物接触面积,加快反应速率,提高原料利用率 ![]() 增大反应物氧气的浓度,可使化学速率加快,增加软锰矿转化率
增大反应物氧气的浓度,可使化学速率加快,增加软锰矿转化率 ![]()
![]()
![]() :2
:2 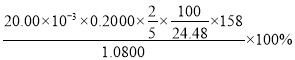
【解析】
软锰矿氢氧化钾按比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,提高反应速率,加热通入预热的空气,在“平炉”中发生反应2MnO2+4KOH+O2 ![]() 2K2MnO4+2H2O,生成物质水浸沉降析出晶体得到锰酸钾,CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2和KHCO3,“电解法”为现代工艺,即电解K2MnO4水溶液,在电解槽中阳极,MnO42-失去电子,发生氧化反应,产生MnO4-,以此解答该题。
2K2MnO4+2H2O,生成物质水浸沉降析出晶体得到锰酸钾,CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2和KHCO3,“电解法”为现代工艺,即电解K2MnO4水溶液,在电解槽中阳极,MnO42-失去电子,发生氧化反应,产生MnO4-,以此解答该题。
![]() 原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是增大接触面积加快反应速率,提高原料利用率;
原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是增大接触面积加快反应速率,提高原料利用率;
![]() 流程分析可知平炉中发生的反应是氢氧化钾、二氧化锰和氧气加热反应生成锰酸钾和水,反应的化学方程式为:
流程分析可知平炉中发生的反应是氢氧化钾、二氧化锰和氧气加热反应生成锰酸钾和水,反应的化学方程式为:![]() ;
;
![]() “平炉”中加压,增大反应物氧气的浓度,能提高反应速率增加软锰矿转化率;
“平炉”中加压,增大反应物氧气的浓度,能提高反应速率增加软锰矿转化率;
![]() 在
在![]() 溶液中通入
溶液中通入![]() 气体,使体系呈中性或弱酸性,
气体,使体系呈中性或弱酸性,![]() 发生歧化反应,根据元素守恒以及二氧化碳过量推测反应生成
发生歧化反应,根据元素守恒以及二氧化碳过量推测反应生成![]() ,
,![]() 和
和![]() ;
;
![]() “电解法”为现代工艺,即电解
“电解法”为现代工艺,即电解![]() 水溶液,在电解槽中阳极,
水溶液,在电解槽中阳极,![]() 失去电子,发生氧化反应,产生
失去电子,发生氧化反应,产生![]() ,电极反应式是:
,电极反应式是: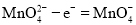 ;
;
![]() 依据电解法方程式
依据电解法方程式![]() ,可知
,可知![]() 的理论利用率是
的理论利用率是![]() ,而在二氧化碳歧化法反应中3K2MnO4+2CO2=2KMnO4+MnO2+K2CO3中
,而在二氧化碳歧化法反应中3K2MnO4+2CO2=2KMnO4+MnO2+K2CO3中![]() 的理论利用率是
的理论利用率是![]() ,所以二者的理论利用率之比为3:2;
,所以二者的理论利用率之比为3:2;
![]() 依据离子方程式
依据离子方程式![]() ,可知
,可知![]() 与草酸反应的定量关系是
与草酸反应的定量关系是![]() ,
,![]() ,
,![]() ,
,![]() 样品中
样品中![]() ,
,![]() 样品中
样品中![]() ,样品的纯度
,样品的纯度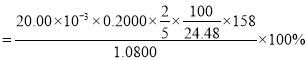 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如图所示:
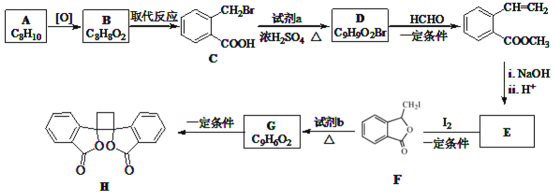
已知:
![]()
![]() R—HC=CH—R’
R—HC=CH—R’
ii.R—HC=CH—R’![]()
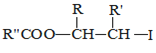
iii.R—HC=CH—R’![]()
![]() 以上R、
以上R、![]() 、
、![]() 代表氢、烷基或芳基等
代表氢、烷基或芳基等![]()
![]() 属于芳香烃,其名称是______。
属于芳香烃,其名称是______。
![]() 的结构简式是______。
的结构简式是______。
![]() 由F生成G的反应类型是______。
由F生成G的反应类型是______。
![]() 由E与
由E与![]() 在一定条件下反应生成F的化学方程式是______;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是______。
在一定条件下反应生成F的化学方程式是______;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是______。
![]() 下列说法正确的是______
下列说法正确的是______![]() 选填字母序号
选填字母序号![]() 。
。
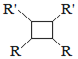
A.G存在顺反异构体
B.由G生成H的反应是加成反应
C.1molG最多可以与1mol![]() 发生加成反应
发生加成反应
D.1molF或1molH与足量NaOH溶液反应,均消耗2molNaOH
![]() 以乙烯为起始原料,结合已知信息选用必要的无机试剂合成
以乙烯为起始原料,结合已知信息选用必要的无机试剂合成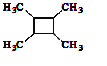 ,写出合成路线
,写出合成路线![]() 用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件
用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件![]() 。______。
。______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是________,证明Fe3+存在的现象是________。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:________。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式。
①________,④________。
(4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
①加入足量氯水②加入足量KMnO4溶液③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(5)写出向②⑤的混合液中通入⑥的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种,为确定其成分,完成了如下实验
中的几种,为确定其成分,完成了如下实验![]() 已知:
已知:![]()
![]() 根据实验现象,所得结论错误的是
根据实验现象,所得结论错误的是![]()
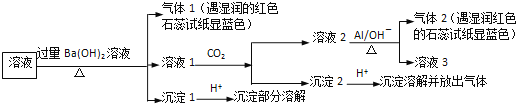
A.沉淀1加酸部分溶解,则含![]() 和
和![]()
B.可能含![]() 、
、![]()
C.沉淀2加酸溶解,则含![]()
D.气体1遇水显碱性,则含![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数。
(1)在CB3分子中C元素原子的原子轨道发生的是____杂化,CB3分子的空间构型为____。
(2)C的氢化物极易溶于水的原因是____。
(3)D元素与同周期相邻元素的第一电离能由大到小的关系是:____(用元素符号表示);
(4)氧原子的价层电子的轨道表示式为____。
(5)X与Y所形成化合物晶体的晶胞如图所示。
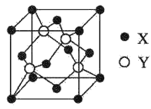
①在一个晶胞中,X离子的数目为____;
②若该化合物的密度为ag·cm-3,则晶胞的体积是____cm3(只要求列出计算式,阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
A、量取20.0ml待测盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞;
B、用标准溶液润洗滴定管2-3次;
C、取盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D、取标准NaOH溶液注入碱式滴定管至刻度线0以上2cm-3cm;
E、调节液面至“0”或“0”以下刻度并记下读数;
F、把锥形瓶放在滴定管的下面,用NaOH溶液滴定至终点并记下滴定管液面的刻度
据此实验完成填空:
(1)正确操作步骤的顺序是___。(用序号字母填写)
(2)用标准的NaOH溶液滴定待测盐酸时,左手握碱式滴定管的带有玻璃球的橡胶管部分,右手摇动锥形瓶,眼睛注视___。判断滴定终点的方法是___。
(3)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测液 体积(mL) | 标准NaOH溶液体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
1 | 20.00 | 1.02 | 21.03 |
2 | 20.00 | 2.00 | 21.99 |
3 | 20.00 | 1.20 | 23.20 |
①根据上述数据,可计算出该盐酸的浓度为___(保留两位有效数字).
②在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有___(填字母序号)
A.滴定终点读数时俯视读数
B.碱式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题。

(1)化学反应速率本质上是由_____________ 决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3表明_____________ 对反应速率有影响,该因素对反应速率的具体影响是其他条件相同时,_____________反应速率越快。
(2)我们选取实验_____________(填实验序号)研究锌的形状对反应速率的影响。我们发现在其他条件相同时,反应物间的_____________反应速率越快。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少硫酸铜溶液,发现反应速率明显加快,原因是 _____________。
(4)利用表中数据,可以求出硫酸的物质的量浓度是_____________![]() (计算结果精确到小数点后一位)。
(计算结果精确到小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 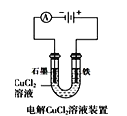 中阳极处能产生使湿润淀粉KI试纸变蓝的气体
中阳极处能产生使湿润淀粉KI试纸变蓝的气体
B. 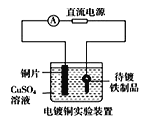 中待镀铁制品应与电源正极相连
中待镀铁制品应与电源正极相连
C. 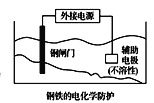 中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法
中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法
D. 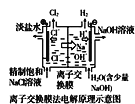 中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知海水中的溴含量约为65 mg/L,从海水中提取溴的工业流程如下:
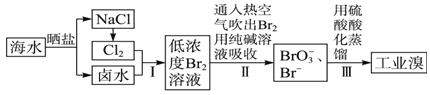
(1)上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是_____________。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的____________(填序号)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在方框内填入正确的化学计量数:
_____Br2+_____CO32-=_____BrO3-+_____Br-+_____ CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com