
【题目】下列说法正确的是( )
A. 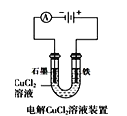 中阳极处能产生使湿润淀粉KI试纸变蓝的气体
中阳极处能产生使湿润淀粉KI试纸变蓝的气体
B. 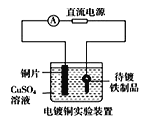 中待镀铁制品应与电源正极相连
中待镀铁制品应与电源正极相连
C. 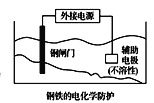 中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法
中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法
D. 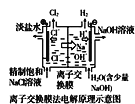 中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
科目:高中化学 来源: 题型:
【题目】取100mL0.2mol/L的FeCl3溶液置于烧杯中,向其中加入一定量的Fe、Cu混合物,充分反应后仍有固体剩余,下列叙述一定正确的是( )(设溶液体积不变,不考虑水解因素)。
A.烧杯中有Fe无Cu,c(Fe2+)=0.2mol/L
B.烧杯中有Cu无Fe,c(Fe2+)=0.3mol/L
C.烧杯中有Cu无Fe,0.2mol/L![]() c(Fe2+)
c(Fe2+)![]() 0.3mol/L
0.3mol/L
D.烧杯中Fe、Cu均有,c(Fe2+)=0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)元素周期表是我们研究物质性质、结构的重要工具,对周期表的熟悉和掌握程度直接影响我们对化学的学习。元素周期表共有七个周期十六个族;第ⅠA族元素(除氢外)的最高价氧化物对应水化物都是易溶于水的强碱,又称为___元素,卤族元素位于第__纵行,最高正价与最低负价的绝对值相等的元素位于___族。
(2)A、B、C、D、E、F、G为原子序数依次增大的前20号元素(此时不考虑稀有气体元素),在周期表中B和C,C和E分别相邻,B、E、G的最外层电子数之和为12。已知部分元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
A | 该元素有一种核素质量数为1 |
B | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
D | 原子的次外层电子数是最外层电子数的两倍 |
①由元素A、B形成的核外电子总数为10e-的两种微粒:___,___(写化学式)。
②C元素在周期中的位置:___。
③C、D形成的化合物在通讯上的重要用途___。
④E与G两元素可形成化合物,用电子式表示其化合物的形成过程:___。
⑤用化学方程式表示B、D两种元素的非金属性强弱___。
⑥A、B、F三种元素形成的一种常见化合物易溶于水,受热易分解,可用于制作干电池,该物质的电子式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和CO合成甲醇反应为:CO(g)+2H2(g)![]() CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2molCO和1molH2,10min后达到平衡,测得含有0.4molCH3OH(g)。则达到平衡时CO的浓度为___;10min内用H2表示的化学反应速率为___;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有___(填一种合理的措施)。
CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2molCO和1molH2,10min后达到平衡,测得含有0.4molCH3OH(g)。则达到平衡时CO的浓度为___;10min内用H2表示的化学反应速率为___;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有___(填一种合理的措施)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给你提供纯锌、纯铜片和500 mL 0.2 mol·L-1的H2SO4溶液、导线、1000 mL量筒。试用下图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。

(1)如图所示,装置气密性良好,且1000 mL量筒中已充满了水,则开始实验时,a电极材料为________,其电极反应式为________。b电极材料为________,其电极反应式为________。
(2)当量筒中收集到672 mL气体时(已折算到标准状况下),通过导线的电子的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度变化如图所示。据图分析,下列判断正确的是( )
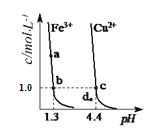
A. Ksp[Cu(OH)2]数量级为10-20
B. d点表示Cu(OH)2形成饱和溶液
C. 加适量NH4Cl固体可使溶液由a点变到b点
D. b、c两点表示Fe(OH)3、Cu(OH)2溶解度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下图装置,下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. a和b分别连接直流电源正、负极,Cu2+向铜电极移动
D. 无论a和b是否连接,铁片均会溶解,溶液颜色都会发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl-,降低对电解的影响,反应原理如下:Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=akJ/mol;Cl-(aq)+Cu+(aq)
2Cu+(aq) ΔH1=akJ/mol;Cl-(aq)+Cu+(aq)![]() CuCl(s) ΔH2=bkJ/mol,实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。下列说法正确的是( )
CuCl(s) ΔH2=bkJ/mol,实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。下列说法正确的是( )
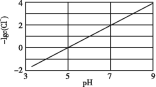
A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡后,增大c(Cu2+),c(Cl-)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl-(aq)
Cu2+(aq)+Cl-(aq)![]() CuCl(s)的ΔH=(a+2b)kJ/mol
CuCl(s)的ΔH=(a+2b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100mL甲气体依次通过下图实验的处理,结果得到酸性溶液,几乎无气体剩余,则甲气体的组成为

A.NH3、NO2、N2B.NH3、NO、CO2
C.NH3、NO2、CO2D.NO、CO2、N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com