
【题目】已知海水中的溴含量约为65 mg/L,从海水中提取溴的工业流程如下:
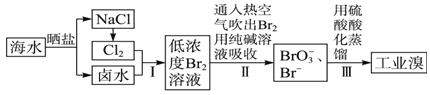
(1)上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是_____________。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的____________(填序号)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在方框内填入正确的化学计量数:
_____Br2+_____CO32-=_____BrO3-+_____Br-+_____ CO2↑
【答案】富集溴元素 C 3 3 1 5 3
【解析】
由流程可知,海水晒盐得到NaCl、卤水(含溴离子),电解NaCl生成氯气,氯气与卤水发生氧化还原反应生成溴,利用纯碱吸收发生3Br2+3CO32-=BrO3-+5Br-+ 3CO2↑,酸性条件下溴酸根离子和溴离子发生氧化还原反应得到溴单质,然后蒸馏可得到工业溴。
(1)步骤Ⅰ中已获得游离态的溴的含量较低,步骤Ⅱ又将之转化为化合态的溴,其目的是富集溴元素;
(2)步骤Ⅱ通入热空气吹出Br2,是利用了溴单质易挥发的性质,故合理选项是C;
(3)Br元素的化合价由0升高为+5价,Br元素的化合价由0降低为-1价,由电子、电荷守恒及原子守恒可知,离子方程式为:3Br2+3CO32-=BrO3-+5Br-+ 3CO2↑,化学计量数分别是3;3;1;5;3。


科目:高中化学 来源: 题型:
【题目】高锰酸钾![]() 是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿
是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿![]() 主要成分为
主要成分为![]() 为原料生产高锰酸钾的工艺路线如下:
为原料生产高锰酸钾的工艺路线如下:
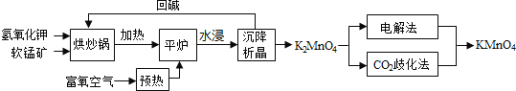
回答下列问题:
![]() 原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 __________________________________________;
原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 __________________________________________;
![]() “平炉”中发生的化学方程式为 _______________________________;
“平炉”中发生的化学方程式为 _______________________________;
![]() “平炉”中需要加压,其目的是 _______________________________;
“平炉”中需要加压,其目的是 _______________________________;
![]() 将
将![]() 转化为
转化为![]() 的生产有两种工艺:
的生产有两种工艺:
![]() “
“![]() 歧化法”是传统工艺,即在
歧化法”是传统工艺,即在![]() 溶液中通入
溶液中通入![]() 气体,使体系呈中性或弱酸性,
气体,使体系呈中性或弱酸性,![]() 发生歧化反应,反应中生成
发生歧化反应,反应中生成![]() ,
,![]() 和 __________________
和 __________________![]() 写化学式
写化学式![]() ;
;
![]() “电解法”为现代工艺,即电解
“电解法”为现代工艺,即电解![]() 水溶液,电解槽中阳极发生的电极反应为______________________________________________;
水溶液,电解槽中阳极发生的电极反应为______________________________________________;
![]() “电解法”和“
“电解法”和“![]() 歧化法”中,
歧化法”中,![]() 的理论利用率之比为______;
的理论利用率之比为______;
![]() 高锰酸钾纯度的测定:称取
高锰酸钾纯度的测定:称取![]() 样品,溶解后定容于100mL容量瓶中,摇匀。取浓度为
样品,溶解后定容于100mL容量瓶中,摇匀。取浓度为![]() 的
的![]() 标准溶液
标准溶液![]() ,加入稀硫酸酸化,用
,加入稀硫酸酸化,用![]() 溶液平行滴定三次,平均消耗的体积为
溶液平行滴定三次,平均消耗的体积为![]() ,该样品的纯度为_____________
,该样品的纯度为_____________![]() 列出计算式即可,已知
列出计算式即可,已知![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物有如下转化关系:
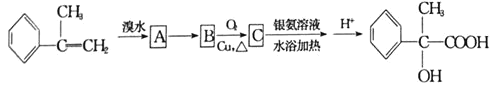
(1)写出反应![]() 的反应条件是________,C中官能团的结构简式是________________。
的反应条件是________,C中官能团的结构简式是________________。
(2)反应![]() 的反应类型为________________________。
的反应类型为________________________。
(3)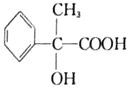 在浓硫酸加热条件下可以生成含有三个六元环结构的环酯,该有机物结构简式为:________________。
在浓硫酸加热条件下可以生成含有三个六元环结构的环酯,该有机物结构简式为:________________。
(4)任意写出一种符合下列条件的C的同分异构体的结构简式:________________。
①属于芳香族化合物,苯环上有两个取代基
②与碳酸氢钠溶液反应放出二氧化碳气体
③苯环上的一氯代物有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙炔能够导电,下列关于聚乙炔(![]() )和聚合物M(
)和聚合物M(![]() )的说法正确的是( )
)的说法正确的是( )
A.两种聚合物的单体互为同系物
B.聚合物M的单体中含有碳碳双键
C.聚合物M的相对分子质量是聚乙炔的两倍
D.两种聚合物的单体各1 mol,分别与Br2发生加成反应时最多消耗Br2的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组在网上收集到如下信息:以贫软锰矿和有色金属冶炼厂的![]() 废气为原料制备高纯碳酸锰.已知,贫软锰矿的主要成分为
废气为原料制备高纯碳酸锰.已知,贫软锰矿的主要成分为![]() 和少量
和少量![]() 、
、![]() 、
、![]() 等杂质.工艺流程如图1:
等杂质.工艺流程如图1:

已知:有关氢氧化物沉淀pH对应表
物质 | 开始沉淀时的pH | 完全沉淀时的pH |
氢氧化铁 |
|
|
氢氧化铝 |
|
|
氢氧化亚铁 |
|
|
请回答:
![]() 在浸出液除杂过程中需通入适量空气并调节溶液的pH到
在浸出液除杂过程中需通入适量空气并调节溶液的pH到![]() ,沉淀部分杂质离子,此时滤渣I中主要含有 ______
,沉淀部分杂质离子,此时滤渣I中主要含有 ______ ![]() 填化学式
填化学式![]() .
.
![]() 影响浸锰率的操作因素有多种,其中温度选择不合理时会产生杂质
影响浸锰率的操作因素有多种,其中温度选择不合理时会产生杂质![]() 造成锰损失.温度对浸锰率的影响见图2、图3.
造成锰损失.温度对浸锰率的影响见图2、图3.
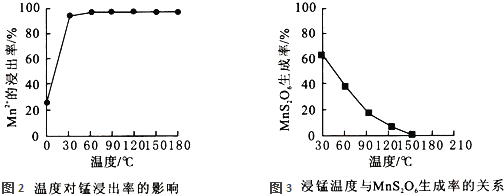
为了提高锰的浸出率,请选择合适的条件 ______ ![]() 填序号
填序号![]()
![]() 以上
以上
![]() 在滤液中加入
在滤液中加入![]() 生成
生成![]() 的同时还可以获得一种作为肥料的副产物,写出该过程的化学反应方程式 ______ ,从废液中分离出该副产物的操作是蒸发浓缩、 ______
的同时还可以获得一种作为肥料的副产物,写出该过程的化学反应方程式 ______ ,从废液中分离出该副产物的操作是蒸发浓缩、 ______ ![]() 若该分离过程在实验室进行,其中除了需要酒精灯、蒸发皿、玻璃棒外,还需要 ______ .
若该分离过程在实验室进行,其中除了需要酒精灯、蒸发皿、玻璃棒外,还需要 ______ .
![]() 现有含锰质量分数为
现有含锰质量分数为![]() 的贫锰矿1吨,若按照上述工艺锰的产率为
的贫锰矿1吨,若按照上述工艺锰的产率为![]() ,最终获得碳酸锰的质量 ______ .
,最终获得碳酸锰的质量 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
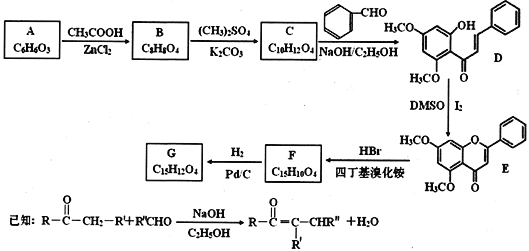
【题目】化合物G是一种具有多种药理学活性的黄烷酮类药物。实验室由芳香化合物A制备G的合成路线如下:
回答以下问题:
(1)A中的官能团名称为________________。E的分子式为________________。
(2)由A生成B和由F生成G的反应类型分别是________________、____________。
(3)由C生成D的化学方程式为____________________。
(4)G的结构简式为____________________。
(5)芳香化合物X是B的同分异构体,可与FeCl3溶液发生显色反应,1molX可与4 mol NaOH反应,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为3:2:2:1。写出一种符合要求的X的结构简式____________。
(6)写出用环戊烯和正丁醛为原料制备化合物![]() 的合成路线(其他试剂任选):__
的合成路线(其他试剂任选):__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成分是MgO,还有CaO、MnO、![]() 、FeO、
、FeO、![]() ,、
,、![]() 等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业.从硼镁泥中制取
等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业.从硼镁泥中制取![]() 的工艺流程如下:
的工艺流程如下:
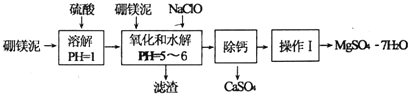
已知:NaClO与![]() 反应产生
反应产生![]() 沉淀.
沉淀.
沉淀物 |
|
|
|
开始沉淀pH |
|
|
|
完全沉淀pH |
|
|
|
![]() 实验中需用
实验中需用![]() 的硫酸
的硫酸![]() 若用
若用![]() 的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有 ______ .
的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有 ______ .
![]() 滤渣的主要成分除含有
滤渣的主要成分除含有![]() 、
、![]() 外,还有 ______ .
外,还有 ______ .
![]() “操作I”的主要操作为蒸发浓缩、冷却结晶、 ______ .
“操作I”的主要操作为蒸发浓缩、冷却结晶、 ______ .
![]() 写出加入NaClO时,溶液中氧化还原反应的离子方程式 ______ 、 ______ .
写出加入NaClO时,溶液中氧化还原反应的离子方程式 ______ 、 ______ .
![]() 已知:溶液的
已知:溶液的![]() 时,铝元素有多种存在形态,如
时,铝元素有多种存在形态,如![]() 、
、![]() 、
、![]() 等,各形态之间可相互转化,写出该溶液中
等,各形态之间可相互转化,写出该溶液中![]() 转化为
转化为![]() 的离子方程式 ______ ;
的离子方程式 ______ ;
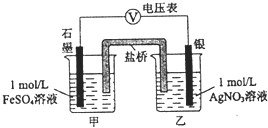
![]() 某同学为探究
某同学为探究![]() 和
和![]() 反应,按如图连接装置并加入药品
反应,按如图连接装置并加入药品![]() 盐桥中的物质不参与反应
盐桥中的物质不参与反应![]() ,发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓
,发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓![]() 溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为 ______ 极
溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为 ______ 极![]() 填“正”或“负”
填“正”或“负”![]() 由实验得出
由实验得出![]() 和
和![]() 反应的离子方程式是 ______
反应的离子方程式是 ______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知表中是某些有机物的模型图,根据要求回答下列问题:
有机物 | 甲 | 乙 | 丙 |
模型 |
|
|
|
(1)甲的分子式是___________________,其一氯代物有___________________种。
(2)写出乙与![]() 的
的![]() 溶液发生反应的化学方程式:______________________________________,该反应的反应类型是___________________。
溶液发生反应的化学方程式:______________________________________,该反应的反应类型是___________________。
(3)丙的摩尔质量为![]() ,则用苯制备该物质时的催化剂是___________________。
,则用苯制备该物质时的催化剂是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
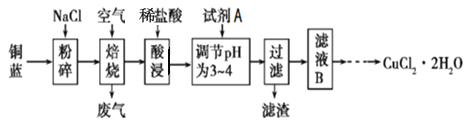
【题目】铜蓝是一种天然含铜矿石,它的主要成分是CuS,同时还含有少量铁的化合物。工业上常以铜蓝为原料生产可用作颜料、木材防腐剂等的化工产品![]() ,其工艺流程如下:
,其工艺流程如下:
已知:![]() 、
、![]() 、
、![]() 完全沉淀时的pH分别为
完全沉淀时的pH分别为![]() 、
、![]() 、
、![]() 。
。
![]() 与
与![]() 的溶解度曲线如图所示。
的溶解度曲线如图所示。

![]() “焙烧”时,主反应的产物为等物质的量的两种盐。写出相应的化学反应方程式 _________________________。
“焙烧”时,主反应的产物为等物质的量的两种盐。写出相应的化学反应方程式 _________________________。
![]() 结合题意,试剂A最好选用______
结合题意,试剂A最好选用______![]() 填编号
填编号![]()
![]()
![]()
![]()
![]() 浓硫酸
浓硫酸
选择该试剂的理由是____________________________。所得滤渣为________________。
![]() 为了获得
为了获得![]() 晶体,对滤液B进行的操作是:蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品。分析有关物质的溶解度曲线
晶体,对滤液B进行的操作是:蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品。分析有关物质的溶解度曲线![]() 图
图![]() ,“趁热过滤”得到的固体是_____________,“冷却结晶”过程中,析出
,“趁热过滤”得到的固体是_____________,“冷却结晶”过程中,析出![]() 晶体的合适温度为___________________。
晶体的合适温度为___________________。
![]() 色光度是产品质量指标之一,合格
色光度是产品质量指标之一,合格![]() 晶体的色光度范围为
晶体的色光度范围为![]() ,反应过程溶液pH对产率、色光度的影响如图2所示,综合考虑制备时应控制pH的较合理范围是_______________。
,反应过程溶液pH对产率、色光度的影响如图2所示,综合考虑制备时应控制pH的较合理范围是_______________。
![]() 已知铜蓝的形成过程如下:
已知铜蓝的形成过程如下:![]() 在自然界中,各种原生铜的矿物经氧化转变为可溶性的
在自然界中,各种原生铜的矿物经氧化转变为可溶性的![]() 溶液,
溶液,![]() 经淋滤作用后溶液向地壳深部渗透,遇到深层的闪锌矿
经淋滤作用后溶液向地壳深部渗透,遇到深层的闪锌矿![]() 或方铅矿
或方铅矿![]() 慢慢转化为铜蓝
慢慢转化为铜蓝![]() 。写出过程
。写出过程![]() 中任意一个反应的离子方程式 ________________。
中任意一个反应的离子方程式 ________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com