
【题目】已知表中是某些有机物的模型图,根据要求回答下列问题:
有机物 | 甲 | 乙 | 丙 |
模型 |
|
|
|
(1)甲的分子式是___________________,其一氯代物有___________________种。
(2)写出乙与![]() 的
的![]() 溶液发生反应的化学方程式:______________________________________,该反应的反应类型是___________________。
溶液发生反应的化学方程式:______________________________________,该反应的反应类型是___________________。
(3)丙的摩尔质量为![]() ,则用苯制备该物质时的催化剂是___________________。
,则用苯制备该物质时的催化剂是___________________。
【答案】![]() 4
4 ![]() 加成反应 FeBr3
加成反应 FeBr3
【解析】
⑴根据A的结构式得到A含有5个碳原子12个氢原子,该结构有4种不同位置的氢。
⑵乙的结构式得到乙的结构简式为CH3CH2CH=CH2。
⑶根据丙的结构得到C6H5X,根据丙的摩尔质量为![]() 得丙的名称。
得丙的名称。
⑴根据A的结构式得到A含有5个碳原子12个氢原子,因此A的分子式为C5H12,该结构有4种不同位置的氢,因此一氯代物有4种;故答案为:C5H12;4。
⑵乙的结构式得到乙的结构简式为CH3CH2CH=CH2,与溴单质发生加成反应,反应方程式为:![]() ;故答案为:
;故答案为:![]() ;加成反应。
;加成反应。
⑶根据丙的结构得到C6H5X,根据丙的摩尔质量为![]() ,得到X为Br,因此丙为溴苯,由苯制备溴苯时催化剂是FeBr3;故答案为:FeBr3。
,得到X为Br,因此丙为溴苯,由苯制备溴苯时催化剂是FeBr3;故答案为:FeBr3。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 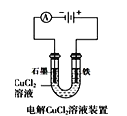 中阳极处能产生使湿润淀粉KI试纸变蓝的气体
中阳极处能产生使湿润淀粉KI试纸变蓝的气体
B. 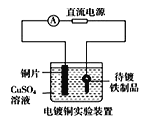 中待镀铁制品应与电源正极相连
中待镀铁制品应与电源正极相连
C. 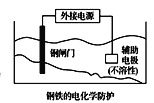 中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法
中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法
D. 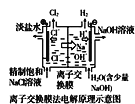 中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知海水中的溴含量约为65 mg/L,从海水中提取溴的工业流程如下:
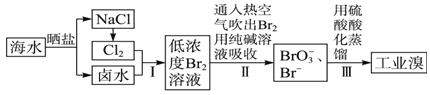
(1)上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是_____________。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的____________(填序号)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在方框内填入正确的化学计量数:
_____Br2+_____CO32-=_____BrO3-+_____Br-+_____ CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铅蓄电池为电源,石墨为电极电解CuSO4溶液(足量),装置如下图。若一段时间后Y电极上有6.4 g红色物质析出,停止电解。下列说法正确的是( )
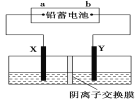
A.a为铅蓄电池的负极
B.电解过程中SO42-向右侧移动
C.电解结束时,左侧溶液质量增重8 g
D.铅蓄电池工作时正极电极反应式为:PbSO4+2e-===Pb+SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)乙醇—氧气燃料电池是一种清洁能源,该电池用金属铂片插入氢氧化钾溶液中作电极,在两极区分别加入乙醇和氧气,其负极反应式为:_____________。
(2)古代铁器(埋藏在地下)在严重缺氧的环境中,仍然锈蚀严重。原因是一种叫做硫酸盐还原菌的细菌,能提供正极反应的催化剂,可将土壤中的![]() 还原为S2-,该反应放出的能量供给细菌生长、繁殖之需。①写出该电化学腐蚀的正极反应式:____________。
还原为S2-,该反应放出的能量供给细菌生长、繁殖之需。①写出该电化学腐蚀的正极反应式:____________。
②文物出土前,铁器表面的腐蚀产物可能有(写化学式)____________。
(3)对金属制品进行抗腐蚀处理,可延长其使用寿命。以下为铝材表面处理的一种方法:
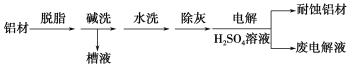
①碱洗的目的是除去铝材表面的自然氧化膜。碱洗时常有气泡冒出,原因是(用离子方程式表示):____________。
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为:____________。取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是____________。
(4)采用石墨电极电解CuSO4溶液一段时间后,向所得溶液中加入0.1molCu(OH)2后,恰好使溶液恢复到电解前的浓度。则电解过程中通过导线的电量为____________C(已知NA=6.02×1023mol—1,1个电子所带的电量为1.60×10-19C)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:
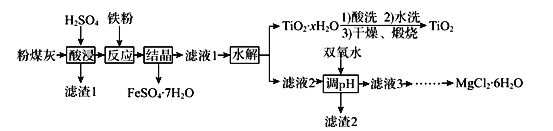
已知:①“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子
②常温下,Ksp[Al(OH)3]=1.0×10-34,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mg(OH)2]= 5.61×10-12
③滤液1中仍有Fe2+剩余
请回答下列问题:
(1)为了提高粉煤灰浸出速率,在“酸浸”时可采取的措施有_______________________
(2)“水解”反应的离子方程式为______________________________________。怎样判断TiO2xH2O沉淀已经洗涤干净____________________________________________。
(3)加入双氧水调节溶液pH时离子方程式为_______________________________________。滤渣2成分为________________。为使滤渣2沉淀完全(溶液中离子浓度小于10-5mol/L)。需“调pH”为________。(保留两位有效数字)
(4)滤液3在蒸发结晶制备MgCl26H2O应注意_____________________________________。
(5)“结晶”需控制在70℃左右,温度过高的后果会导致的后果为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取的乙烯中常混有少量的![]() ,有人设计如图实验装置以证明上述混合气体中含有乙烯和二氧化硫。试回答下列问题:
,有人设计如图实验装置以证明上述混合气体中含有乙烯和二氧化硫。试回答下列问题:
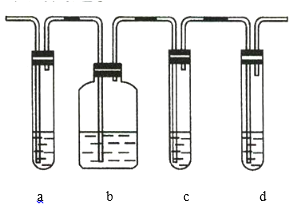
(1)图中a、b、c、d装置盛放的试剂依次是___________________(填序号)。
A.品红溶液 B.![]() 溶液 C.浓硫酸 D.酸性高锰酸钾溶液
溶液 C.浓硫酸 D.酸性高锰酸钾溶液
(2)能说明![]() 存在的实验现象是______________________________________。
存在的实验现象是______________________________________。
(3)使用装置b的目的是________________________。
(4)使用装置c的目的是________________________。
(5)能说明混合气体中含有乙烯的现象是____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度下,有相同体积的甲、乙两容器,且保持体积不变,甲容器中充入 1 mol SO2 和 1 mol O2,乙容器中充入 2 mol SO2 和 2 mol O2。下列叙述中正确的是( )
A.平衡时 SO2 的转化率:乙<甲B.平衡时 O2 的浓度:乙<甲
C.化学反应速率:乙<甲D.平衡时 SO2 的体积分数:乙<甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有图1、2所示的装置,下列叙述正确的是( )


图1 图2
A.将乙烯分别通入两个装置中,二者都褪色且原理相同
B.若某气体均能使二者褪色,说明该气体一定含乙烯
C.二者都可用于除去乙烷中混有的乙烯
D.二者都可用于鉴别乙烷和乙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com