
【题目】某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:
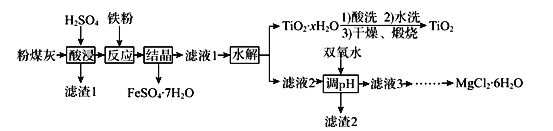
已知:①“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子
②常温下,Ksp[Al(OH)3]=1.0×10-34,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mg(OH)2]= 5.61×10-12
③滤液1中仍有Fe2+剩余
请回答下列问题:
(1)为了提高粉煤灰浸出速率,在“酸浸”时可采取的措施有_______________________
(2)“水解”反应的离子方程式为______________________________________。怎样判断TiO2xH2O沉淀已经洗涤干净____________________________________________。
(3)加入双氧水调节溶液pH时离子方程式为_______________________________________。滤渣2成分为________________。为使滤渣2沉淀完全(溶液中离子浓度小于10-5mol/L)。需“调pH”为________。(保留两位有效数字)
(4)滤液3在蒸发结晶制备MgCl26H2O应注意_____________________________________。
(5)“结晶”需控制在70℃左右,温度过高的后果会导致的后果为________________________。
【答案】 适当升高温度,增大硫酸的浓度,将粉煤灰研成粉末或搅拌等 TiO2++(x+1)H2O=TiO2·xH2O+2H+ 取最后一次洗涤液,加入氯化钡溶液,没有白色沉淀生成,则洗干净 2Fe2++H2O2+2H+ = 2Fe3++2H2O Al(OH)3 Fe(OH)3 4.3 在不断通入HCl(或者加入盐酸),不断搅拌并且不能蒸干 TiO2+离子提前水解
【解析】试题分析:(1)根据影响反应速率的因素分析; (2) 强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子,阳离子是TiO2+,根据流程图TiO2+水解为TiO2·xH2O;若洗涤液中不含SO42-可证明沉淀已经洗涤干净;(3)加入双氧水,溶液中Fe2+被氧化为Fe3+;根据流程图可知,加入双氧水调节溶液pH时,溶液中Fe3+、Al3+都生成沉淀而除去;根据常温下,Ksp[Al(OH)3]=1.0×10-34,Ksp[Fe(OH)3]=4.0×10-38可知,氢氧化铝的溶解度大于氢氧化铁,所以根据Ksp[Al(OH)3]计算沉淀完全时的PH;(4)滤液3在蒸发结晶制备MgCl26H2O应防止镁离子水解;(5)“结晶”时,温度过高促进TiO2+离子水解;
解析:升高温度,增大硫酸的浓度,将粉煤灰研成粉末或搅拌等,都能加快煤灰浸出速率;(2)根据流程图TiO2+水解为TiO2·xH2O,水解方程式是TiO2++(x+1)H2O=TiO2·xH2O+2H+;若洗涤液中不含SO42-,可证明沉淀已经洗涤干净,操作方法是:取最后一次洗涤液,加入氯化钡溶液,没有白色沉淀生成,则洗干净;(3)加入双氧水,溶液中Fe2+被氧化为Fe3+,反应离子方程式是2Fe2++H2O2+2H+ = 2Fe3++2H2O;根据流程图可知,加入双氧水调节溶液pH时,溶液中Fe3+、Al3+都生成沉淀而除去,所以滤渣2成分为Al(OH)3、Fe(OH)3;氢氧化铝的溶解度大于氢氧化铁,所以根据Ksp[Al(OH)3],沉淀完全时的![]() ,PH=4.3;(4)滤液3在蒸发结晶制备MgCl26H2O应防止镁离子水解,所以要不断通入HC1(或者加入盐酸),不断搅拌并且不能蒸干;(5)“结晶”时,温度过高促进TiO2+离子水解,所以“结晶”需控制在70℃左右;
,PH=4.3;(4)滤液3在蒸发结晶制备MgCl26H2O应防止镁离子水解,所以要不断通入HC1(或者加入盐酸),不断搅拌并且不能蒸干;(5)“结晶”时,温度过高促进TiO2+离子水解,所以“结晶”需控制在70℃左右;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知十种物质:①H2O ②空气 ③ Mg ④ CaO ⑤H2SO4 ⑥氢氧化钡 ⑦饱和FeCl3溶液 ⑧氨水 ⑨HNO3 ⑩胆矾,根据上述提供的物质,回答下列问题:
(1)属于混合物的是___________(填序号,下同),属于弱电解质的是_______________。
(2)上述物质中_____与_____在水溶液中可发生反应,且离子方程式为H++OH-===H2O。
(3)实验室制备少量Fe(OH)3胶体所用的物质有____________,反应的离子方程式为_____________________________________________。
(4)实验室配制900mL 0.1mol/L硫酸铜溶液,需要称取的溶质(从上述物质中选取)的质量为________g,从配制好的溶液中取出300mL,其中含有SO42-的数目为_______(设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将 1.0 L w mol·L-1 CH3COOH 溶液与 0.1 mol NaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH的变化如图。下列叙述正确的是
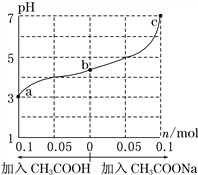
A. b点混合液中c(Na+)>c(CH3COO-)
B. 加入CH3COOH过程中,![]() 增大
增大
C. c点存在:c(CH3COOH)+c(CH3COO-) =0.1+w
D. a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx会造成大气污染,工业上采用多种方法进行处理。
I. 氯气氧化法:![]() 。 恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2。10min达平衡,测得10min内v(ClNO)=0.005mol/(L·min),则平衡后n(Cl2)=________mol。若其它条件不变,上述反应在恒压条件下进行,平衡时NO 的转化率______(填“增大”、“减小”或“不变”),此条件下的平衡常数K值为_______
。 恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2。10min达平衡,测得10min内v(ClNO)=0.005mol/(L·min),则平衡后n(Cl2)=________mol。若其它条件不变,上述反应在恒压条件下进行,平衡时NO 的转化率______(填“增大”、“减小”或“不变”),此条件下的平衡常数K值为_______
II. 臭氧氧化法:烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知:常温下,Ksp(CaSO4)=9.1×10-6,Ksp(CaSO3)=3.1×10-7。
(1)NO与O3反应过程的能量变化如下:
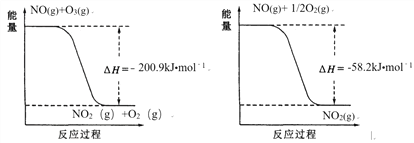
NO被O3氧化的总反应是化合反应,该反应的热化学方程式为 _______________。
(2)将CaSO3悬浊液静置,取上层清液,测得pH约为8,用化学用语解释其原因为_______________________________________。
(3)实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:______________________________________。
III. 选择性非催化还原法:用同位素示踪法,在高温有氧下NH3做还原剂与 15NO 进行选择性反应。
请将该反应的化学方程式补充完整:____________________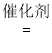 □15NN+□H2O
□15NN+□H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向H2CO3溶液中滴入NaOH溶液,溶液中H2CO3、HCO3-及CO32-的物质的量分数δ(X)随溶液pH的变化如图所示{δ(X)=[c(X)/c(H2CO3)+c(HCO3-)+c(CO32-)]×100%}。
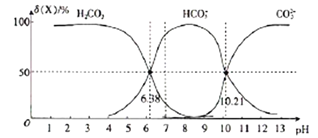
下列说法错误的是
A. H2CO3的一级电离平衡常数的对数值lgK1(H2CO3)=-6.38
B. pH=13时,c(Na+)十c(H+)=c(OH-)+2c(CO32-)
C. 25℃时,反应CO32-+H2O![]() HCO3-+OH-的平衡常数对数值1gK=-3.79
HCO3-+OH-的平衡常数对数值1gK=-3.79
D. pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知丙酮(C3H6O)通常是无色液体,易溶于水,密度小于1g·mL-1,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,下列方法中最为合理的是( )
A.蒸馏B.分液C.过滤D.蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有16.4克O2和CO2的混合气体,在标准状况下其体积为8.96L。请回答下列问题:
(1)该混合气体的平均摩尔质量为_________________;
(2)混合气体中碳原子的个数为___________(用NA表示阿伏加德罗常数的值);
(3)将混合气体依次通过如图所示装置,最后收集在气球中(体积在标准状况下测定)
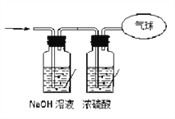
①气球中收集到的气体中,电子总数为________(用NA表示阿伏加德罗常数的值);
②气球的体积为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.第三周期的元素的原子核外都有三个电子层
B.第ⅠA族元素都是典型的金属元素
C.氟、氯、氧、氮四种元素都是第ⅦA族的元素
D.原子的最外层有两个电子的元素都在第ⅡA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com