
【题目】已知十种物质:①H2O ②空气 ③ Mg ④ CaO ⑤H2SO4 ⑥氢氧化钡 ⑦饱和FeCl3溶液 ⑧氨水 ⑨HNO3 ⑩胆矾,根据上述提供的物质,回答下列问题:
(1)属于混合物的是___________(填序号,下同),属于弱电解质的是_______________。
(2)上述物质中_____与_____在水溶液中可发生反应,且离子方程式为H++OH-===H2O。
(3)实验室制备少量Fe(OH)3胶体所用的物质有____________,反应的离子方程式为_____________________________________________。
(4)实验室配制900mL 0.1mol/L硫酸铜溶液,需要称取的溶质(从上述物质中选取)的质量为________g,从配制好的溶液中取出300mL,其中含有SO42-的数目为_______(设NA为阿伏加德罗常数的值)。
【答案】②⑦⑧ ① ⑥ ⑨ ①⑦ Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+ 25.0 0.03NA
Fe(OH)3(胶体)+3H+ 25.0 0.03NA
【解析】
(1)根据物质的组成和概念判断物质的分类:②空气、⑦饱和FeCl3溶液 ⑧氨水由两种或两种以上不同物质组成的物质组成,为混合物;弱电解质是在水溶液里部分电离的电解质,包括弱酸、弱碱、水与少数盐,①H2O属于弱电解质;故答案为②⑦⑧;①;
(2)离子反应H++OH-===H2O代表强酸和强碱反应生成可溶性的盐和水的反应,如Ba(OH)2+2HNO3═Ba(NO3)2+2H2O等,故答案为:⑥、⑨;
(3)实验室制备氢氧化铁胶体的方法是:加热烧杯中的水至沸腾,向沸水滴加几滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,即停止加热,反应原理为:Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+;故答案为①⑦;Fe3++3H2O
Fe(OH)3(胶体)+3H+;故答案为①⑦;Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+;
Fe(OH)3(胶体)+3H+;
(4)由于实验室中没有900mL容量瓶,只能选用1000mL容量瓶,即需要配制1000mL 0.1mol/L的硫酸铜溶液,溶液中硫酸铜的物质的量为:1L×0.1mol/L=0.1mol,需要称取胆矾的质量为0.1mol×250g/mol=25.0g;从配制好的溶液中取出300mL,浓度不变,则其中含有SO42-的数目为0.1mol×0.3L×3NA =0.03NA。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,一定错误的是

A. Ⅰ、Ⅱ装置之间缺少干燥装置 B. CuO没有全部被还原
C. Ⅱ装置中玻璃管内有水冷凝 D. Ⅲ装置后缺少干燥装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2-氨基-3-氯苯甲酸(F)是重要的医药中间体,其制备流程图如下:

已知:
回答下列问题:
(1)写出下列反应的类型:反应②________________;反应⑤____________。
(2)A的分子式为___________。![]() 共面原子数目最多为__________________。
共面原子数目最多为__________________。
(3)B的名称为__________。写出符合下列条件B的同分异构体的结构简式__________。
a.苯环上只有两个取代基且互为邻位 b.既能发生银镜反应又能发生水解反应
(4)该流程未采用甲苯直接硝化的方法制备B,而是经由①②③三步反应制取B,其目的是______________________。
(5)写出反应⑥的化学方程式:_________________________________。
(6)写出⑧的反应试剂和条件:_________________________________。
(7)写出以苯为主要原料,经最少步骤制备苯胺(![]() )的流程(例如由多糖制备葡萄糖的流程图:
)的流程(例如由多糖制备葡萄糖的流程图:![]() )_____________。
)_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向60mLNa2SO4溶液中加入BaCl2溶液,有关数据见下表,下列有关说法正确的是
实验编号 | 1 | 2 | 3 | 4 | 5 |
BaCl2溶液体/ mL | 0 | 30 | 60 | 100 | 120 |
沉淀质量/g | 0 | 0.699 | x | 2.097 | 2.097 |
A. 混合前,BaCl2溶液的物质的量浓度为0.05 mol/L
B. 混合前,Na2SO4溶液的物质的量浓度为0.30 mol/L
C. 实验3中沉淀的质量x为1.398g
D. 完全沉淀60mLNa2SO4溶液,消耗BaCl2溶液的体积为80mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,设消耗CH3COOH溶液的体积依次为![]() ,则两者的关系正确的是( )
,则两者的关系正确的是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
【答案】D
【解析】试题分析:醋酸是弱酸,存在电离平衡,稀释促进电离。所以pH为2和3的CH3COOH溶液的浓度前者大于后者的10倍,所以中和等物质的量的氢氧化钠消耗醋酸溶液的体积应该是![]() ,答案选D。
,答案选D。
考点:考查弱电解质的电离以及外界条件对电离平衡的影响
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识的巩固和训练的同时,侧重对学生能力的培养和方法的指导与训练,有利于培养学生的逻辑推理能力和抽象思维能力。
【题型】单选题
【结束】
22
【题目】某烷烃的各种同分异构体中,主链上有4个碳原子的只有两种结构,则含有相同碳原子数且主链上也有4个碳原子的烯烃(只含一个碳碳双键)的同分异构体有( )
A. 2种 B. 3种 C. 4种 D. 5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝, 有“光明使者”的美誉。钨在自然界主要以钨 (+6价) 酸盐的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。白钨矿的主要成分是钨酸钙(CaWO4);黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(FeWO4和MnWO4),钨酸(H2WO4)酸性很弱,难溶于水。
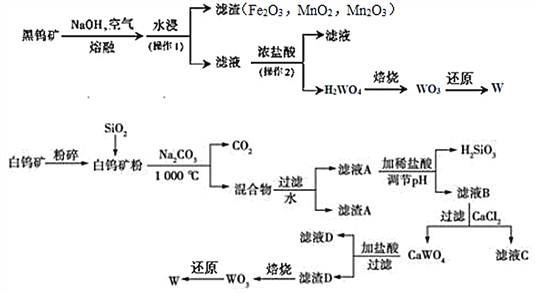
已知:①CaWO4与碳酸钠共热发生复分解反应。
②钨在高温下可与焦炭(C)反应生成硬质合金碳化钨(WC)。
(1)74W在周期表的位置是第_______周期。
(2)写出黑钨矿中FeWO4与氢氧化钠,空气熔融时的化学反应方程式________________________________;白钨矿粉与碳酸钠共热的化学反应方程式_______________。
(3)工业上,可用一氧化碳、氢气或铝还原WO3冶炼W。理论上,等物质的量的CO、H2、Al作还原剂,可得到W的质量之比为______。用焦炭也能还原WO3,但用氢气更具有优点,其理由是_____________________________________。
(4)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则T1时Ksp(CaWO4)=_________(mol/L)2。将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为_____________________________,T2时该反应的平衡常数为__________。

(5)工业上,可用电解法从碳化钨废料中回收钨。碳化钨作阳极,不锈钢作阴极,盐酸为电解质溶液,阳极析出滤渣D并放出CO2。写出阳极的电极反应式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)环境质量的优劣与健康均有密切的关系。
①优雅的家居环境令人心情舒畅,装修过程中不合理的是____(填字母)。
a.选用符合国标的环保建材 b.家居绿色化 c.选用大量天然石材
②医疗垃圾中含有多种致病微生物,属于高危险性、高污染性废物,若处理不当,极易造成传染病的急性流行外,还将对环境造成二次污染。对医疗垃圾,人们主要采取______处理。
③用铁去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一,下图表示该反应在pH=2.5时反应原理示意图。写出此时铁与硝酸根反应的离子方程式:__________。

(2)材料是人类赖以生存和发展的重要物质基础。
①聚对苯二甲酰对苯二胺纤维俗称凯夫拉,具有密度低、强度髙、韧性好、耐高温、易于加工和成型等特性,是防弹衣的优质选材,它属于_____(填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
②下列不属于传统硅酸盐材料的是________(填字母)。
a.陶瓷 b.有机玻璃 c.水泥
③云轨使城市出行绿色快捷,云轨机身采用了铝合金框架,下列不属于铝合金性质的____(填字母)。
a.耐腐蚀 b.密度大 c.强度大
(3)均衡营养、合理用药是保证人体健康的重要途径。
①某品牌绿茶饮料产品标签如图所示。配料中属于甜味剂的是_____、________;属于防腐剂的是_______;

②碘被称为“智力元素”,______(化学式)是目前碘盐中添加的主要含碘物质。
③葡萄糖是人体内最重要的供能物质,葡萄糖的结构简式为_________。
④用亚硝酸钠腌制的肉品呈现鲜艳的红色。腌制过程中亚硝酸钠生成少量亚硝酸(HNO2)。亚硝酸分解生成NO和一种强酸,写出该反应的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:
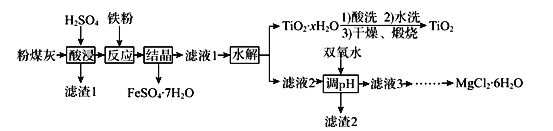
已知:①“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子
②常温下,Ksp[Al(OH)3]=1.0×10-34,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mg(OH)2]= 5.61×10-12
③滤液1中仍有Fe2+剩余
请回答下列问题:
(1)为了提高粉煤灰浸出速率,在“酸浸”时可采取的措施有_______________________
(2)“水解”反应的离子方程式为______________________________________。怎样判断TiO2xH2O沉淀已经洗涤干净____________________________________________。
(3)加入双氧水调节溶液pH时离子方程式为_______________________________________。滤渣2成分为________________。为使滤渣2沉淀完全(溶液中离子浓度小于10-5mol/L)。需“调pH”为________。(保留两位有效数字)
(4)滤液3在蒸发结晶制备MgCl26H2O应注意_____________________________________。
(5)“结晶”需控制在70℃左右,温度过高的后果会导致的后果为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com