
【题目】NOx会造成大气污染,工业上采用多种方法进行处理。
I. 氯气氧化法:![]() 。 恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2。10min达平衡,测得10min内v(ClNO)=0.005mol/(L·min),则平衡后n(Cl2)=________mol。若其它条件不变,上述反应在恒压条件下进行,平衡时NO 的转化率______(填“增大”、“减小”或“不变”),此条件下的平衡常数K值为_______
。 恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2。10min达平衡,测得10min内v(ClNO)=0.005mol/(L·min),则平衡后n(Cl2)=________mol。若其它条件不变,上述反应在恒压条件下进行,平衡时NO 的转化率______(填“增大”、“减小”或“不变”),此条件下的平衡常数K值为_______
II. 臭氧氧化法:烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知:常温下,Ksp(CaSO4)=9.1×10-6,Ksp(CaSO3)=3.1×10-7。
(1)NO与O3反应过程的能量变化如下:
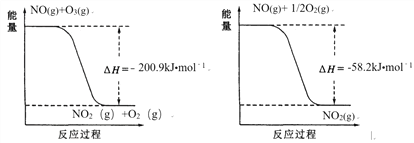
NO被O3氧化的总反应是化合反应,该反应的热化学方程式为 _______________。
(2)将CaSO3悬浊液静置,取上层清液,测得pH约为8,用化学用语解释其原因为_______________________________________。
(3)实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:______________________________________。
III. 选择性非催化还原法:用同位素示踪法,在高温有氧下NH3做还原剂与 15NO 进行选择性反应。
请将该反应的化学方程式补充完整:____________________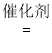 □15NN+□H2O
□15NN+□H2O
【答案】 0.05 增大 40 3NO(g) + O3(g) ![]() 3NO2(g) ΔH= -317.3 kJmol﹣1 SO32- + H2O
3NO2(g) ΔH= -317.3 kJmol﹣1 SO32- + H2O ![]() HSO3- + OH- CaSO3浊液中存在:CaSO3(s)
HSO3- + OH- CaSO3浊液中存在:CaSO3(s) ![]() Ca2+(aq) + SO32-(aq),加入Na2SO4固体,由于CaSO4的Ksp较小,SO42-与Ca2+结合生成CaSO4沉淀,c(Ca2+)减小,平衡正向移动,导致c(SO32-)增大,从而使NO2的吸收速率加快 4NH3 + 415NO + O2 4 6 (2分)
Ca2+(aq) + SO32-(aq),加入Na2SO4固体,由于CaSO4的Ksp较小,SO42-与Ca2+结合生成CaSO4沉淀,c(Ca2+)减小,平衡正向移动,导致c(SO32-)增大,从而使NO2的吸收速率加快 4NH3 + 415NO + O2 4 6 (2分)
【解析】I. 10min内v(ClNO)=0.005mol/(L·min),则平衡后n (ClNO)=0.005mol/(L·min) ![]() 10min
10min ![]() 2L=0.1mol,n(Cl2)=0.1mol-
2L=0.1mol,n(Cl2)=0.1mol-![]()
![]() 0.1mol=0.05mol;若其它条件不变,上述反应在恒压条件下进行,相当于与原来相比增大压强,平衡正向移动,则平衡时NO 的转化率增大,此条件下的平衡常数K值为
0.1mol=0.05mol;若其它条件不变,上述反应在恒压条件下进行,相当于与原来相比增大压强,平衡正向移动,则平衡时NO 的转化率增大,此条件下的平衡常数K值为![]() ;
;
II. (1)根据图中信息可知①NO(g) + O3(g)= NO2(g)+ O2(g) ΔH= -200.9 kJmol﹣1,②NO(g)+ ![]() O2(g)= NO2(g) ΔH= -58.2 kJmol﹣1,根据盖斯定律,由①+②
O2(g)= NO2(g) ΔH= -58.2 kJmol﹣1,根据盖斯定律,由①+②![]() 得反应3NO(g) + O3(g)
得反应3NO(g) + O3(g) ![]() 3NO2(g) ΔH= -317.3 kJmol﹣1;(2)将CaSO3悬浊液静置,取上层清液,测得pH约为8,原因为亚硫酸根离子水解呈碱性SO32- + H2O
3NO2(g) ΔH= -317.3 kJmol﹣1;(2)将CaSO3悬浊液静置,取上层清液,测得pH约为8,原因为亚硫酸根离子水解呈碱性SO32- + H2O ![]() HSO3- + OH-;(3)实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:CaSO3浊液中存在:CaSO3(s)
HSO3- + OH-;(3)实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:CaSO3浊液中存在:CaSO3(s) ![]() Ca2+(aq) + SO32-(aq),加入Na2SO4固体,由于CaSO4的Ksp较小,SO42-与Ca2+结合生成CaSO4沉淀,c(Ca2+)减小,平衡正向移动,导致c(SO32-)增大,从而使NO2的吸收速率加快;III.在高温有氧下NH3做还原剂与 15NO 进行选择性反应,生成15NN和H2O;反应的化学方程式补充完整为:4NH3 + 4span>15NO + O2
Ca2+(aq) + SO32-(aq),加入Na2SO4固体,由于CaSO4的Ksp较小,SO42-与Ca2+结合生成CaSO4沉淀,c(Ca2+)减小,平衡正向移动,导致c(SO32-)增大,从而使NO2的吸收速率加快;III.在高温有氧下NH3做还原剂与 15NO 进行选择性反应,生成15NN和H2O;反应的化学方程式补充完整为:4NH3 + 4span>15NO + O2 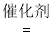 415NN+6H2O。
415NN+6H2O。


科目:高中化学 来源: 题型:
【题目】向60mLNa2SO4溶液中加入BaCl2溶液,有关数据见下表,下列有关说法正确的是
实验编号 | 1 | 2 | 3 | 4 | 5 |
BaCl2溶液体/ mL | 0 | 30 | 60 | 100 | 120 |
沉淀质量/g | 0 | 0.699 | x | 2.097 | 2.097 |
A. 混合前,BaCl2溶液的物质的量浓度为0.05 mol/L
B. 混合前,Na2SO4溶液的物质的量浓度为0.30 mol/L
C. 实验3中沉淀的质量x为1.398g
D. 完全沉淀60mLNa2SO4溶液,消耗BaCl2溶液的体积为80mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)环境质量的优劣与健康均有密切的关系。
①优雅的家居环境令人心情舒畅,装修过程中不合理的是____(填字母)。
a.选用符合国标的环保建材 b.家居绿色化 c.选用大量天然石材
②医疗垃圾中含有多种致病微生物,属于高危险性、高污染性废物,若处理不当,极易造成传染病的急性流行外,还将对环境造成二次污染。对医疗垃圾,人们主要采取______处理。
③用铁去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一,下图表示该反应在pH=2.5时反应原理示意图。写出此时铁与硝酸根反应的离子方程式:__________。

(2)材料是人类赖以生存和发展的重要物质基础。
①聚对苯二甲酰对苯二胺纤维俗称凯夫拉,具有密度低、强度髙、韧性好、耐高温、易于加工和成型等特性,是防弹衣的优质选材,它属于_____(填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
②下列不属于传统硅酸盐材料的是________(填字母)。
a.陶瓷 b.有机玻璃 c.水泥
③云轨使城市出行绿色快捷,云轨机身采用了铝合金框架,下列不属于铝合金性质的____(填字母)。
a.耐腐蚀 b.密度大 c.强度大
(3)均衡营养、合理用药是保证人体健康的重要途径。
①某品牌绿茶饮料产品标签如图所示。配料中属于甜味剂的是_____、________;属于防腐剂的是_______;

②碘被称为“智力元素”,______(化学式)是目前碘盐中添加的主要含碘物质。
③葡萄糖是人体内最重要的供能物质,葡萄糖的结构简式为_________。
④用亚硝酸钠腌制的肉品呈现鲜艳的红色。腌制过程中亚硝酸钠生成少量亚硝酸(HNO2)。亚硝酸分解生成NO和一种强酸,写出该反应的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我校环保兴趣小组在处理污水样品时,需用2mol·L-1的盐酸配制成250mL 0.1mol·L-1的盐酸溶液。
(1)计算所需2mol·L-1的盐酸的体积是_______________。
(2)在下图所示仪器中,配制上述溶液不需要的是_____________(填相应仪器的序号); 除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________________。

(3)在容量瓶的使用方法中,下列操作正确的是_________________。
A、使用容量瓶前检查它是否漏水
B、容量瓶用水洗净后,再用配好的稀HCl溶液润洗
C、配制溶液时,将量筒量取好的盐酸直接倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
D、盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(4)配制时其他操作均正确,若定容时俯视刻度线,所配溶液的物质的量浓度______。(填“偏高”;“ 偏低”“ 无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某火电厂收捕到的粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等。研究小组对其进行综合处理的流程如下:
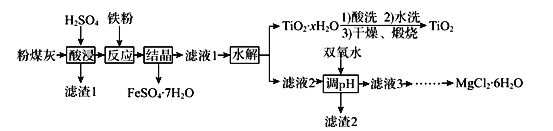
已知:①“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子
②常温下,Ksp[Al(OH)3]=1.0×10-34,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mg(OH)2]= 5.61×10-12
③滤液1中仍有Fe2+剩余
请回答下列问题:
(1)为了提高粉煤灰浸出速率,在“酸浸”时可采取的措施有_______________________
(2)“水解”反应的离子方程式为______________________________________。怎样判断TiO2xH2O沉淀已经洗涤干净____________________________________________。
(3)加入双氧水调节溶液pH时离子方程式为_______________________________________。滤渣2成分为________________。为使滤渣2沉淀完全(溶液中离子浓度小于10-5mol/L)。需“调pH”为________。(保留两位有效数字)
(4)滤液3在蒸发结晶制备MgCl26H2O应注意_____________________________________。
(5)“结晶”需控制在70℃左右,温度过高的后果会导致的后果为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道:“染色”馒头中添加柠檬黄铬酸铅(PbCrO4)会使人体致癌,已被明文禁用。已知铅元素(Pb)化合价为+2,则铬元素(Cr)的化合价为( )
A.+5B.+6C.+7D.+8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com