
【题目】据报道:“染色”馒头中添加柠檬黄铬酸铅(PbCrO4)会使人体致癌,已被明文禁用。已知铅元素(Pb)化合价为+2,则铬元素(Cr)的化合价为( )
A.+5B.+6C.+7D.+8
科目:高中化学 来源: 题型:
【题目】NOx会造成大气污染,工业上采用多种方法进行处理。
I. 氯气氧化法:![]() 。 恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2。10min达平衡,测得10min内v(ClNO)=0.005mol/(L·min),则平衡后n(Cl2)=________mol。若其它条件不变,上述反应在恒压条件下进行,平衡时NO 的转化率______(填“增大”、“减小”或“不变”),此条件下的平衡常数K值为_______
。 恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2。10min达平衡,测得10min内v(ClNO)=0.005mol/(L·min),则平衡后n(Cl2)=________mol。若其它条件不变,上述反应在恒压条件下进行,平衡时NO 的转化率______(填“增大”、“减小”或“不变”),此条件下的平衡常数K值为_______
II. 臭氧氧化法:烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知:常温下,Ksp(CaSO4)=9.1×10-6,Ksp(CaSO3)=3.1×10-7。
(1)NO与O3反应过程的能量变化如下:
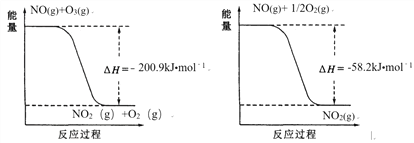
NO被O3氧化的总反应是化合反应,该反应的热化学方程式为 _______________。
(2)将CaSO3悬浊液静置,取上层清液,测得pH约为8,用化学用语解释其原因为_______________________________________。
(3)实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:______________________________________。
III. 选择性非催化还原法:用同位素示踪法,在高温有氧下NH3做还原剂与 15NO 进行选择性反应。
请将该反应的化学方程式补充完整:____________________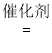 □15NN+□H2O
□15NN+□H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向H2CO3溶液中滴入NaOH溶液,溶液中H2CO3、HCO3-及CO32-的物质的量分数δ(X)随溶液pH的变化如图所示{δ(X)=[c(X)/c(H2CO3)+c(HCO3-)+c(CO32-)]×100%}。
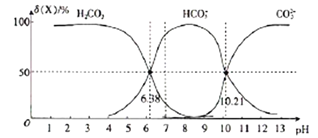
下列说法错误的是
A. H2CO3的一级电离平衡常数的对数值lgK1(H2CO3)=-6.38
B. pH=13时,c(Na+)十c(H+)=c(OH-)+2c(CO32-)
C. 25℃时,反应CO32-+H2O![]() HCO3-+OH-的平衡常数对数值1gK=-3.79
HCO3-+OH-的平衡常数对数值1gK=-3.79
D. pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知丙酮(C3H6O)通常是无色液体,易溶于水,密度小于1g·mL-1,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,下列方法中最为合理的是( )
A.蒸馏B.分液C.过滤D.蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氨与铵盐的叙述中正确的是( )
A.铵盐大都易溶于水
B.干燥 NH3 时,不可以用酸性干燥剂,用中性干燥剂CaCl2 即可
C.铵盐作氮肥时,与生石灰混用的效果更好
D.铵盐加热时都能产生 NH3,并可以用湿润的红色石蕊试纸检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有16.4克O2和CO2的混合气体,在标准状况下其体积为8.96L。请回答下列问题:
(1)该混合气体的平均摩尔质量为_________________;
(2)混合气体中碳原子的个数为___________(用NA表示阿伏加德罗常数的值);
(3)将混合气体依次通过如图所示装置,最后收集在气球中(体积在标准状况下测定)
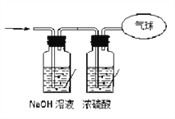
①气球中收集到的气体中,电子总数为________(用NA表示阿伏加德罗常数的值);
②气球的体积为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,下图所示为元素周期表中的一部分。表中所列的字母分别代表对应的化学元素。
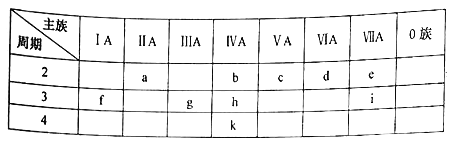
(1)上述元素中,金属性最强的元素在周期表中的位置是______;最高价氧化物对应水化物中酸性最强的元素是___________(填元素符号)。常温下,其单质在浓硝酸中会发生钝化的元素是_______(填元素符号)。
(2)元素g的简单离子结构示意图为______,元素d的一种氢化物中两种原子的个数比为1: 1,则该物质的电子式为___________
(3)k元素可能的性质或应用有________。
A.是一种活泼的金属元素 B.其简单氢化物的热稳定性比h强
C.其单质可作为半导体材料 D.最高正化合价为+4
(4)下列说法正确的是________
A.简单离子半径的大小顺序: r(d>r(e>r(g)>r(f)
B.元素非金属性由强到弱的顺序:e>d>c
C.f、g、i最高价氧化物对应的水化物两两之间能发生反应
D.化合物f2d2中,阴、阳离子个数之比为1:1
(5)元素a与元素g有相似的化学性质。请写出元素a的氢氧化物与NaOH溶液反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能说明元素的金属性或非金属性相对强弱的是( )
序号 | 事实 | 推论 |
A | S(s)+H2(g)=H2S(g) ΔH <0 Se(s)+H2(g)=H2Se(g) ΔH >0 | 非金属性:S >Se |
B | Li在O2中点燃生成Li2O 而Na在O2中点燃生成Na2O2 | 金属性:Na >Li |
C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S > C |
D | t℃时,Br2 + H2 I2 + H2 | 非金属性:Br > I |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com