
【题目】下列事实不能说明元素的金属性或非金属性相对强弱的是( )
序号 | 事实 | 推论 |
A | S(s)+H2(g)=H2S(g) ΔH <0 Se(s)+H2(g)=H2Se(g) ΔH >0 | 非金属性:S >Se |
B | Li在O2中点燃生成Li2O 而Na在O2中点燃生成Na2O2 | 金属性:Na >Li |
C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S > C |
D | t℃时,Br2 + H2 I2 + H2 | 非金属性:Br > I |
A. A B. B C. C D. D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】据报道:“染色”馒头中添加柠檬黄铬酸铅(PbCrO4)会使人体致癌,已被明文禁用。已知铅元素(Pb)化合价为+2,则铬元素(Cr)的化合价为( )
A.+5B.+6C.+7D.+8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把18.0mol/L的浓硫酸稀释成1.2mol/L的稀硫酸250mL。
(1)1.2mol/L的稀硫酸的含义是__________(选填字母)。
A.1L水中含有1.2mol H2SO4
B.1L溶液中含有1.2mol H+
C.将117.6g硫酸溶于1L水所配成的溶液
D.从100mL该溶液中取出10mL,剩余溶液的物质的量浓度仍为1.2mol/L
(2)请在下列操作步骤中填写有关的空格:
①用量筒量取_________mL的18.0mol/L的浓硫酸;
②将_______________沿烧杯内壁慢慢注入盛有少量____________的烧杯中;
③将已冷却至室温的硫酸溶液沿玻璃棒注入_________mL的容量瓶中;
④用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑤继续向容量瓶中加蒸馏水,直至液面接近刻度线1~2cm处;
⑥改用___________________逐滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
⑦盖好容量瓶塞,反复颠倒,摇匀;
⑧将配好的稀硫酸倒入试剂瓶中,贴好标签。
(3)由于操作不当,会引起实验误差。下列情况对所配制的H2SO4溶液的物质的量浓度有何影响?(用“偏高”、“偏低”、“无影响”填空)。
①容量瓶用蒸馏水洗涤后残留有少量的水_____________;
②定容时,某同学观察液面的情况如图所示_____________;

③摇匀后,发现溶液的液面低于刻度线,又加水至刻度线____________。
(4)某同学取配制的1.2mol/L的稀硫酸100mL,向其中加入足量的锌粒,产生的H2在标准状况下的体积为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原料药合成路线如下:
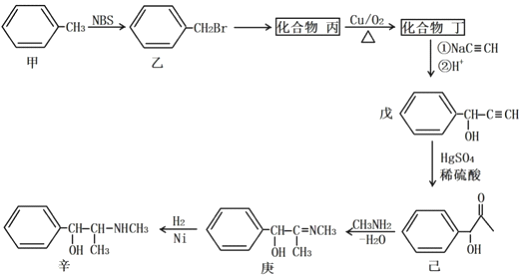
(1)甲→乙的反应类型为_______________;乙→丙的反应条件为__________________。
(2)丁的名称为______________;戊分子含的官能团的名称为______________________;己的分子式为______________________;
(3)己→庚的化学方程式为________________________。
(4)化合物己的芳香族同分异构体有多种,A和B是其中的两类,它们的结构和性质如下:
①己知A遇FeC13溶液发生显色反应,能和银氨溶液发生银镜反应,苯环上只有两个对位取代基,则A 的结构简式可能为_________________或_________________。
②已知B中含有甲基,能发生水解反应,苯环上只有一个取代基,则B的结构有_________种。
(5)丁烯酮(![]() )可用作聚合反应单体制取阴离子树脂,还可用作烷基化剂和合成甾族化合物及维生素A的中间体。请以乙烯和乙炔钠(NaC
)可用作聚合反应单体制取阴离子树脂,还可用作烷基化剂和合成甾族化合物及维生素A的中间体。请以乙烯和乙炔钠(NaC![]() CH) 为原料(无机试剂任选),设计制备丁烯酮的合成路线:________。合成路线流程图示例如:
CH) 为原料(无机试剂任选),设计制备丁烯酮的合成路线:________。合成路线流程图示例如:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子能大量共存的是( )
A. 稀硫酸中:K+、Mg2+、A1O2-、S2O32-
B. KW/c(H+)=10-13 mol·L-1 的溶液中:Fe3+、NH4+、Mg2+、SO42-
C. 使甲基橙变红的溶液中:Fe2+、MnO4﹣、Na+、SO42﹣
D. 通入大量 CO2 的溶液中:Na+、ClO-、CH3COO-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)NH3的沸点比PH3_____(填“高"或“低”),原因是_____________。
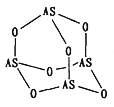
(2)Na3AsO4 中含有的化学键类型包括_______;AsO43-的空间构型为_______,As4O6的分子结构如图所示,则在该化合物中As的杂化方式是_________。
(3)自然固氮现象发生的一系列化学变化:N2→NO→NO2→HNO3→NO3-解释了民谚“雷雨发庄稼”的原理。
①NO3-中N原子采取_____杂化方式,其空间构型为________,写出它的一种等电子体的化学式________.
②已知酸性: HNO3>HNO2,下列相关见解合理的是_________.
A.含氧酸中氧原子总数越多,酸性越强
B.同种元素化合价越高,对应含氧酸的酸性越强
C.HNO3中氮元素的正电性更高,在水溶液中更易电离出H+,酸性强于HNO2
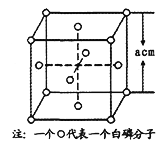
(4)白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。己知晶胞的边长为acm,阿伏加德罗常数为NA mol-1,则该晶胞中含有的P原子的个数为______,该晶体的密度为______g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)若500℃时进行反应①,CO2的起始浓度为2 mol·L-1,CO的平衡浓度为____。
(2)上述反应中的a_______0(填“大于”“小于”或“等于”)。
(3)700℃时反应①达到平衡状态,要使该平衡向右移动,其他条件不变时,可以采取的措施有____(填序号)。
A.缩小反应器体积 B.通入CO2 C.温度升高到900℃ D.使用合适的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com