
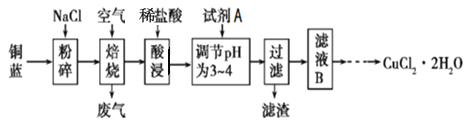
【题目】铜蓝是一种天然含铜矿石,它的主要成分是CuS,同时还含有少量铁的化合物。工业上常以铜蓝为原料生产可用作颜料、木材防腐剂等的化工产品![]() ,其工艺流程如下:
,其工艺流程如下:
已知:![]() 、
、![]() 、
、![]() 完全沉淀时的pH分别为
完全沉淀时的pH分别为![]() 、
、![]() 、
、![]() 。
。
![]() 与
与![]() 的溶解度曲线如图所示。
的溶解度曲线如图所示。

![]() “焙烧”时,主反应的产物为等物质的量的两种盐。写出相应的化学反应方程式 _________________________。
“焙烧”时,主反应的产物为等物质的量的两种盐。写出相应的化学反应方程式 _________________________。
![]() 结合题意,试剂A最好选用______
结合题意,试剂A最好选用______![]() 填编号
填编号![]()
![]()
![]()
![]()
![]() 浓硫酸
浓硫酸
选择该试剂的理由是____________________________。所得滤渣为________________。
![]() 为了获得
为了获得![]() 晶体,对滤液B进行的操作是:蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品。分析有关物质的溶解度曲线
晶体,对滤液B进行的操作是:蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品。分析有关物质的溶解度曲线![]() 图
图![]() ,“趁热过滤”得到的固体是_____________,“冷却结晶”过程中,析出
,“趁热过滤”得到的固体是_____________,“冷却结晶”过程中,析出![]() 晶体的合适温度为___________________。
晶体的合适温度为___________________。
![]() 色光度是产品质量指标之一,合格
色光度是产品质量指标之一,合格![]() 晶体的色光度范围为
晶体的色光度范围为![]() ,反应过程溶液pH对产率、色光度的影响如图2所示,综合考虑制备时应控制pH的较合理范围是_______________。
,反应过程溶液pH对产率、色光度的影响如图2所示,综合考虑制备时应控制pH的较合理范围是_______________。
![]() 已知铜蓝的形成过程如下:
已知铜蓝的形成过程如下:![]() 在自然界中,各种原生铜的矿物经氧化转变为可溶性的
在自然界中,各种原生铜的矿物经氧化转变为可溶性的![]() 溶液,
溶液,![]() 经淋滤作用后溶液向地壳深部渗透,遇到深层的闪锌矿
经淋滤作用后溶液向地壳深部渗透,遇到深层的闪锌矿![]() 或方铅矿
或方铅矿![]() 慢慢转化为铜蓝
慢慢转化为铜蓝![]() 。写出过程
。写出过程![]() 中任意一个反应的离子方程式 ________________。
中任意一个反应的离子方程式 ________________。
【答案】CuS+2NaCl+2O2![]() CuCl2+Na2SO4
CuCl2+Na2SO4 ![]() NaClO溶液显碱性,在氧化残留的
NaClO溶液显碱性,在氧化残留的![]() 的同时能增大溶液的pH值,保证使
的同时能增大溶液的pH值,保证使![]() 沉淀而除去
沉淀而除去 ![]()
![]()
![]()
![]()
![]() 或
或![]()
【解析】
流程分析废渣粉碎加入氯化钠,通入空气焙烧后加入盐酸酸浸,加入试剂A是氧化剂将亚铁离子氧化为铁离子,调节溶液PH使铁离子沉淀;过滤后的滤液中主要是氯化铜溶液蒸发浓缩,冷却结晶得到氯化铜晶体。
![]() 焙烧”时,主反应是硫化铜和氧气在氯化钠的环境中发生氧化还原反应生成等物质的量的两种盐氯化铜和硫酸钠,所以相应的化学反应方程式为:CuS+2NaCl+2O2
焙烧”时,主反应是硫化铜和氧气在氯化钠的环境中发生氧化还原反应生成等物质的量的两种盐氯化铜和硫酸钠,所以相应的化学反应方程式为:CuS+2NaCl+2O2![]() CuCl2+Na2SO4;
CuCl2+Na2SO4;
![]() 结合题意,试剂A是为了氧化二价铁离子,使其转化成三价铁离子达到除杂的目的,又因为不能引入新的杂质,所以最好选用
结合题意,试剂A是为了氧化二价铁离子,使其转化成三价铁离子达到除杂的目的,又因为不能引入新的杂质,所以最好选用![]() ;NaClO溶液显碱性,在氧化残留的
;NaClO溶液显碱性,在氧化残留的![]() 的同时能增大溶液的pH值,保证使
的同时能增大溶液的pH值,保证使![]() 沉淀成氢氧化铁而除去;所得滤渣为
沉淀成氢氧化铁而除去;所得滤渣为![]() ;
;
![]() 为了获得
为了获得![]() 晶体,对滤液B进行的操作是:蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品,分析有关物质的溶解度曲线
晶体,对滤液B进行的操作是:蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品,分析有关物质的溶解度曲线![]() 图
图![]() ,温度高时,氯化铜的溶解度大于硫酸钠的,所以“趁热过滤”得到的固体应是
,温度高时,氯化铜的溶解度大于硫酸钠的,所以“趁热过滤”得到的固体应是![]() ;“冷却结晶”过程中,根据溶解度曲线,析出
;“冷却结晶”过程中,根据溶解度曲线,析出![]() 晶体而又不析出杂质的最佳温度应是
晶体而又不析出杂质的最佳温度应是![]() ;
;
![]() 根据图2综合分析,合格
根据图2综合分析,合格![]() 晶体的色光度范围为
晶体的色光度范围为![]() ,满足此要求又要保证产率高的pH应控制在
,满足此要求又要保证产率高的pH应控制在![]() ;
;
![]() 过程中涉及沉淀的转化,反应的离子方程式可表示为
过程中涉及沉淀的转化,反应的离子方程式可表示为![]() 或
或![]() 。
。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】已知海水中的溴含量约为65 mg/L,从海水中提取溴的工业流程如下:
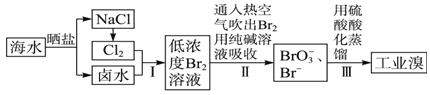
(1)上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是_____________。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的____________(填序号)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在方框内填入正确的化学计量数:
_____Br2+_____CO32-=_____BrO3-+_____Br-+_____ CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取的乙烯中常混有少量的![]() ,有人设计如图实验装置以证明上述混合气体中含有乙烯和二氧化硫。试回答下列问题:
,有人设计如图实验装置以证明上述混合气体中含有乙烯和二氧化硫。试回答下列问题:
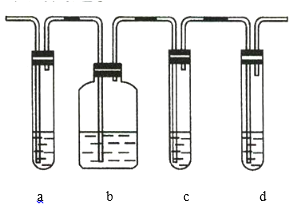
(1)图中a、b、c、d装置盛放的试剂依次是___________________(填序号)。
A.品红溶液 B.![]() 溶液 C.浓硫酸 D.酸性高锰酸钾溶液
溶液 C.浓硫酸 D.酸性高锰酸钾溶液
(2)能说明![]() 存在的实验现象是______________________________________。
存在的实验现象是______________________________________。
(3)使用装置b的目的是________________________。
(4)使用装置c的目的是________________________。
(5)能说明混合气体中含有乙烯的现象是____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度下,有相同体积的甲、乙两容器,且保持体积不变,甲容器中充入 1 mol SO2 和 1 mol O2,乙容器中充入 2 mol SO2 和 2 mol O2。下列叙述中正确的是( )
A.平衡时 SO2 的转化率:乙<甲B.平衡时 O2 的浓度:乙<甲
C.化学反应速率:乙<甲D.平衡时 SO2 的体积分数:乙<甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿![]() 主要成分为
主要成分为![]() ,还有少量CuS、
,还有少量CuS、![]() 等杂质
等杂质![]() 为原料制备绿矾晶体
为原料制备绿矾晶体![]() 的工艺流程如下:
的工艺流程如下:
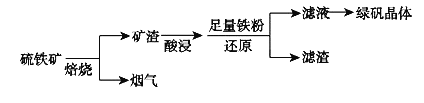
![]() “酸浸”过程,矿渣中的
“酸浸”过程,矿渣中的![]() 与稀
与稀![]() 反应的离子方程式___________________。
反应的离子方程式___________________。
![]() 烟气中的
烟气中的![]() 会污染环境,可用足量氨水吸收,写出该反应的离子方程式________。
会污染环境,可用足量氨水吸收,写出该反应的离子方程式________。
![]() 滤液中金属阳离子的检验方法________________________________。
滤液中金属阳离子的检验方法________________________________。
![]() 溶液制备绿矾晶体过程中要保持
溶液制备绿矾晶体过程中要保持![]() 过量,理由___________________________。
过量,理由___________________________。![]() 结合化学用语说明原因
结合化学用语说明原因![]()
![]() 燃料细菌脱硫法是用氧化亚铁硫杆菌
燃料细菌脱硫法是用氧化亚铁硫杆菌![]() 对硫铁矿进行催化脱硫,同时得到
对硫铁矿进行催化脱硫,同时得到![]() 溶液。其过程如图所示:
溶液。其过程如图所示:
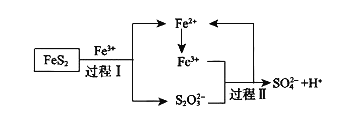
已知总反应为:![]()
![]() 将过程I离子方程式补充完整
将过程I离子方程式补充完整
____FeS2+_____Fe3++______ _______=7Fe2++________S2O32-+_____ _____
![]() 过程II反应的离子方程式___________________________________。
过程II反应的离子方程式___________________________________。
![]() 绿矾晶体在空气中易被氧化。取
绿矾晶体在空气中易被氧化。取![]() 样品,加水完全溶解,用酸化的
样品,加水完全溶解,用酸化的![]() 溶液滴定至终点,消耗
溶液滴定至终点,消耗![]() 溶液
溶液![]() 。反应原理:
。反应原理:![]() 。则绿矾晶体纯度的计算式为_______________。
。则绿矾晶体纯度的计算式为_______________。![]() 摩尔质量为
摩尔质量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中![]() 和
和![]() 的转化和综合利用既有利于节约资源,又有利于保护环境。
的转化和综合利用既有利于节约资源,又有利于保护环境。
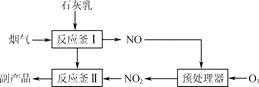
![]() 采用“联合脱硫脱氮技术”处理烟气
采用“联合脱硫脱氮技术”处理烟气![]() 含
含![]() 、
、![]() 、
、![]() 可获得含
可获得含![]() 、
、![]() 、
、![]() 的副产品,工业流程如图1所示。
的副产品,工业流程如图1所示。
![]() 反应釜 Ⅰ中
反应釜 Ⅰ中![]() 与足量石灰乳反应的化学方程式为________。
与足量石灰乳反应的化学方程式为________。
![]() 下列措施能提高各反应釜中气体去除率的有 ________
下列措施能提高各反应釜中气体去除率的有 ________![]() 填字母
填字母![]() 。
。
A. 加快通入气体的速率
B. 采用气、液逆流的方式吸收气体
C. 吸收过程中定期补充吸收液
![]() 反应釜 Ⅱ中
反应釜 Ⅱ中![]() 转化为
转化为![]() 反应的化学方程式为________。
反应的化学方程式为________。
![]() 预处理器中发生的主要反应为
预处理器中发生的主要反应为![]() ,
,![]() 。室温下,固定进入预处理器的NO的物质的量,改变加入
。室温下,固定进入预处理器的NO的物质的量,改变加入![]() 的物质的量,反应一段时间后体系中
的物质的量,反应一段时间后体系中![]() 、
、![]() 随反应前
随反应前![]() 的变化如图2所示。当
的变化如图2所示。当![]() 时,反应后
时,反应后![]() 的物质的量减少,其原因是__________________________________。
的物质的量减少,其原因是__________________________________。
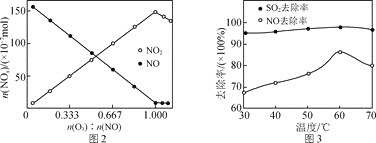
![]() 研究表明:
研究表明:![]() 酸性复合吸收剂可同时有效脱硫、脱硝。图3所示为复合吸收剂组成一定时,温度对脱硫、脱硝的影响。
酸性复合吸收剂可同时有效脱硫、脱硝。图3所示为复合吸收剂组成一定时,温度对脱硫、脱硝的影响。
![]() 温度高于
温度高于![]() 后,NO去除率下降的原因为________。
后,NO去除率下降的原因为________。
![]() 写出废气中的
写出废气中的![]() 与
与![]() 反应的离子方程式:________。
反应的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇烃化新技术是近几年合成氨工业净化精炼原料气,除去少量CO一种新方法,其原理可分为甲醇化与甲烷化两个部分。
甲醇化:![]()
![]()
甲烷化:![]()
![]()
![]() 下列措施有利于提高醇烃化过程CO转化率的是________。
下列措施有利于提高醇烃化过程CO转化率的是________。
A.及时分离出![]() 适当升高反应温度
适当升高反应温度
C.使用高效的催化剂 ![]() 适当增大压强
适当增大压强
![]() 甲醇化平衡常数可用
甲醇化平衡常数可用![]() 表示,
表示,![]() 为平衡组分中各物质的物质的量分数。若CO与
为平衡组分中各物质的物质的量分数。若CO与![]() 混合原料气中CO的体积分数为
混合原料气中CO的体积分数为![]() ,经甲醇化后CO的平衡转化率为w,则
,经甲醇化后CO的平衡转化率为w,则![]() ________
________![]() 用含w的表达式来表示
用含w的表达式来表示![]() 。
。
![]() 测试a、b两种催化剂在不同压强与温度条件下,甲醇化过程中催化效率如下图:
测试a、b两种催化剂在不同压强与温度条件下,甲醇化过程中催化效率如下图:

从上图可知选择哪种催化剂较好________![]() 填a或
填a或![]() ,理由是________。
,理由是________。
![]() 下列关于醇烃化过程说法正确的是________。
下列关于醇烃化过程说法正确的是________。
A.甲醇化与甲烷化过程在任何条件下均为自发反应
B.选择不同的催化剂可以控制醇烃化过程中生成甲醇与甲烷的百分含量
C.当温度与反应容器体积一定时,在原料气中加入少量的惰性气体,有利于提高平衡转化率与甲醇的产率
D.适当增大混合气体中![]() 的百分含量,有利于提高醇烃化过程CO平衡转化率
的百分含量,有利于提高醇烃化过程CO平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有图1、2所示的装置,下列叙述正确的是( )


图1 图2
A.将乙烯分别通入两个装置中,二者都褪色且原理相同
B.若某气体均能使二者褪色,说明该气体一定含乙烯
C.二者都可用于除去乙烷中混有的乙烯
D.二者都可用于鉴别乙烷和乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,三个等体积的干燥圆底烧瓶中分别充满①HCl;②NO2;③体积比为4:1的NO2和O2,进行喷泉实验。经充分反应后烧瓶内溶质的物质的量浓度之比为( )
A.1:1:1B.4:4:5C.5:5:4D.15:10:12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com