
【题目】某溶液可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的几种,为确定其成分,完成了如下实验
中的几种,为确定其成分,完成了如下实验![]() 已知:
已知:![]()
![]() 根据实验现象,所得结论错误的是
根据实验现象,所得结论错误的是![]()
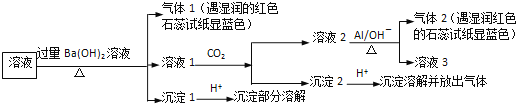
A.沉淀1加酸部分溶解,则含![]() 和
和![]()
B.可能含![]() 、
、![]()
C.沉淀2加酸溶解,则含![]()
D.气体1遇水显碱性,则含![]()
【答案】C
【解析】
试样溶液中加入过量![]() 并加热,生成的气体1能使湿润的红色石蕊试纸变蓝色,说明气体1是
并加热,生成的气体1能使湿润的红色石蕊试纸变蓝色,说明气体1是![]() ,则试样中含有
,则试样中含有![]() ;
;
向滤液中通入![]() ,得到溶液2、沉淀2,溶液2中加入Al,生成气体2,该气体能使湿润红色石蕊试纸变蓝色,说明含有气体2是
,得到溶液2、沉淀2,溶液2中加入Al,生成气体2,该气体能使湿润红色石蕊试纸变蓝色,说明含有气体2是![]() ,根据已知条件知,溶液2中含有
,根据已知条件知,溶液2中含有![]() ,根据元素守恒知,原溶液中含有
,根据元素守恒知,原溶液中含有![]() ;
;
滤液1中通入![]() ,得到沉淀2,向沉淀2中加入酸,沉淀溶解并放出气体,说明沉淀2是碳酸钡等难溶性碳酸盐;
,得到沉淀2,向沉淀2中加入酸,沉淀溶解并放出气体,说明沉淀2是碳酸钡等难溶性碳酸盐;
沉淀1加入酸后,沉淀部分溶解,硫酸钡不溶于酸,说明原来溶液中含有![]() ,能和过量
,能和过量![]() 反应生成能溶于酸的沉淀,根据离子知,该沉淀为
反应生成能溶于酸的沉淀,根据离子知,该沉淀为![]() ,所以溶液中含有
,所以溶液中含有![]() ,
,
A.通过以上分析知,沉淀1加酸部分溶解,试样中肯定存在![]() 、
、![]() ,选项A正确;
,选项A正确;
B、依据分析,不能确定溶液中是否存在![]() 、
、![]() ,选项B正确;
,选项B正确;
C、通过以上分析知,试样中不能确定是否含有![]() ,选项C错误;
,选项C错误;
D、遇水显碱性的气体为氨气,选项D正确;
答案选C。


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
【题目】水合肼![]() 是无色、有强还原性的液体,实验室制备水合肼的原理为
是无色、有强还原性的液体,实验室制备水合肼的原理为![]() 据此,某学生设计了下列实验.
据此,某学生设计了下列实验.
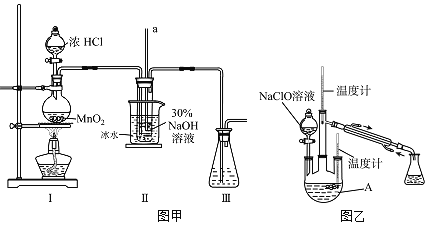
(制备NaClO溶液)实验装置如图甲所示![]() 部分夹持装置已省略
部分夹持装置已省略![]()
已知:3NaClO![]()
![]()
(1)配制![]() 溶液时,所需玻璃仪器除量筒外还有______
溶液时,所需玻璃仪器除量筒外还有______![]() 填字母
填字母![]() 。
。
A.容量瓶![]() 烧杯
烧杯![]() 移液管
移液管![]() 玻璃棒
玻璃棒
(2)装置Ⅰ中发生的离子反应方程式是______;Ⅱ中玻璃管a的作用为______;为了提高NaClO的产率,需对Ⅰ中产生的![]() 进行净化,所用试剂是______;Ⅱ中用冰水浴控制温度在
进行净化,所用试剂是______;Ⅱ中用冰水浴控制温度在![]() 以下,其主要目的______。
以下,其主要目的______。
(制取水合肼)实验装置如图乙所示
(3)仪器A的名称为______;反应过程中,如果分液漏斗中溶液的滴速过快,部分![]() 参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式______;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式______;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
(测定肼的含量)
(4)称取馏分![]() ,加水配成
,加水配成![]() 溶液,在一定条件下,用
溶液,在一定条件下,用![]() 的
的![]() 溶液滴定.已知:
溶液滴定.已知:![]()
![]() 滴定时,可以选用的指示剂为______;
滴定时,可以选用的指示剂为______;
![]() 实验测得消耗
实验测得消耗![]() 溶液的平均值为
溶液的平均值为![]() ,馏分中
,馏分中![]() 的质量分数为______。
的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
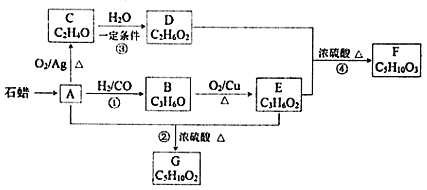
【题目】已知A与![]() 、CO形成B,B能发生银镜反应,C分子中只有一种氢,相关物质转化关系如下
、CO形成B,B能发生银镜反应,C分子中只有一种氢,相关物质转化关系如下![]() 含有相同官能团的有机物通常具有相似的化学性质
含有相同官能团的有机物通常具有相似的化学性质![]() :
:
请回答:
![]() 有机物C的结构简式是______,反应②的反应类型是______。
有机物C的结构简式是______,反应②的反应类型是______。
![]() 写出一定条件下发生反应①的化学方程式______。
写出一定条件下发生反应①的化学方程式______。
![]() 下列说法不正确的是______
下列说法不正确的是______![]() 填字母
填字母![]() 。
。
A.化合物A属于烃
B.化合物D含有两种官能团
C.用金属钠无法鉴别化合物F、G
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国航天航空事业蒸蒸日上,航天航空的关键技术是火箭,火箭燃料有液氢、乙炔![]() 、甲烷、煤油、肼
、甲烷、煤油、肼![]() 等。请回答下列问题:
等。请回答下列问题:
(1)已知肼的结构简式可表示为![]() 。
。
①肼分子中的化学键类型为 _______________________。
②肼在氧气中燃烧生成无毒的物质,则反应中肼断裂的化学键有N—H键、_______________________,新形成的化学键有_______________________ 。
③根据肼燃烧过程中的能量变化,说明反应物能量之和_______________________ (填“大于”“等于”或“小于”)生成物能量之和。
(2)氢燃料汽车中氢的燃烧与火箭中氢的燃烧最大的不同在于前者使用的是空气作氧化剂,而后者使用的是液氧。火箭中不能使用液化空气,原因是_______________________ 。
(3)火箭发射前,当液氢、液氧加到一定量后,技术人员还要不停地补加,请你说出这种做法的原因_______________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是
A.0.1 mol·L-1NaHSO4溶液中:c(Na+)>c(SO42-)>c(H+) >c(OH-)
B.0.1 mol·L-1Na2S溶液中:2 c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:C(Na+)=c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,0.1 mol/L的NH4HCO3溶液pH=7.8。往碳酸的饱和水溶液中通入NH3,测得含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示。下列说法错误的是 ( )
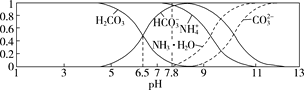
A.常温下,Kb(NH3·H2O)>Ka1(H2CO3)
B.向pH=6.5的上述溶液中通入NH3时,NH4+和HCO3-浓度都逐渐减小
C.NH4HCO3溶液中存在关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾![]() 是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿
是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿![]() 主要成分为
主要成分为![]() 为原料生产高锰酸钾的工艺路线如下:
为原料生产高锰酸钾的工艺路线如下:
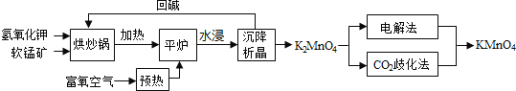
回答下列问题:
![]() 原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 __________________________________________;
原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 __________________________________________;
![]() “平炉”中发生的化学方程式为 _______________________________;
“平炉”中发生的化学方程式为 _______________________________;
![]() “平炉”中需要加压,其目的是 _______________________________;
“平炉”中需要加压,其目的是 _______________________________;
![]() 将
将![]() 转化为
转化为![]() 的生产有两种工艺:
的生产有两种工艺:
![]() “
“![]() 歧化法”是传统工艺,即在
歧化法”是传统工艺,即在![]() 溶液中通入
溶液中通入![]() 气体,使体系呈中性或弱酸性,
气体,使体系呈中性或弱酸性,![]() 发生歧化反应,反应中生成
发生歧化反应,反应中生成![]() ,
,![]() 和 __________________
和 __________________![]() 写化学式
写化学式![]() ;
;
![]() “电解法”为现代工艺,即电解
“电解法”为现代工艺,即电解![]() 水溶液,电解槽中阳极发生的电极反应为______________________________________________;
水溶液,电解槽中阳极发生的电极反应为______________________________________________;
![]() “电解法”和“
“电解法”和“![]() 歧化法”中,
歧化法”中,![]() 的理论利用率之比为______;
的理论利用率之比为______;
![]() 高锰酸钾纯度的测定:称取
高锰酸钾纯度的测定:称取![]() 样品,溶解后定容于100mL容量瓶中,摇匀。取浓度为
样品,溶解后定容于100mL容量瓶中,摇匀。取浓度为![]() 的
的![]() 标准溶液
标准溶液![]() ,加入稀硫酸酸化,用
,加入稀硫酸酸化,用![]() 溶液平行滴定三次,平均消耗的体积为
溶液平行滴定三次,平均消耗的体积为![]() ,该样品的纯度为_____________
,该样品的纯度为_____________![]() 列出计算式即可,已知
列出计算式即可,已知![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下将40g已磨成粉末的![]() 和
和![]() 置于250mL锥形瓶中,迅速搅拌使固体药品混合均匀,再在玻璃管口悬挂一块湿润的红色石蕊试纸(如图所示)。请回答下列问题:
置于250mL锥形瓶中,迅速搅拌使固体药品混合均匀,再在玻璃管口悬挂一块湿润的红色石蕊试纸(如图所示)。请回答下列问题:
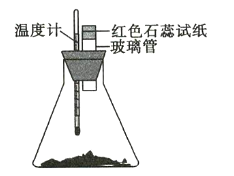
(1)湿润的红色石蕊试纸发生的变化是_________________,其原因是_______。
(2)温度计的变化是_______________________,其原因是_______________________ 。
(3)锥形瓶中发生反应的化学方程式为__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙炔能够导电,下列关于聚乙炔(![]() )和聚合物M(
)和聚合物M(![]() )的说法正确的是( )
)的说法正确的是( )
A.两种聚合物的单体互为同系物
B.聚合物M的单体中含有碳碳双键
C.聚合物M的相对分子质量是聚乙炔的两倍
D.两种聚合物的单体各1 mol,分别与Br2发生加成反应时最多消耗Br2的物质的量之比为2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com