
【题目】用含锂废渣(主要金属元素的含量:Li 3.50% Ni 6.55% Ca 6.41% Mg 13.24%)制备Li2CO3,并用其制备锂电池的正极材料LiFePO4。部分工艺流程如下:
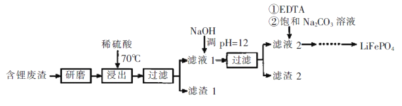
资料:i滤液1、滤液2中部分例子浓度(g·L-1)
Li+ | Ni2+ | Ca2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 0.36 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.08 | 0.78×10-3 |
ii.EDTA能和某些二价金属离子形成稳定的水溶性络合物
iii.某些物质的溶解度(S)
T/℃ | 20 | 40 | 60 | 80 | 100 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
S(Li2SO4)/g | 34.7 | 33.6 | 32.7 | 31.7 | 30.9 |
I.制备Li2CO3粗品
(1)上述流程中为加快化学反应速率而采取的措施是____。
(2)滤渣2的主要成分有____。
(3)向滤液2中先加入EDTA,再加入饱和Na2C03溶液,90℃充分反应后,分离出固体 Li2CO3粗品的操作是_______。
(4)处理lkg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是________g。(摩尔质量:Li2CO3 74 g.mol4)
II.纯化Li2CO3粗品
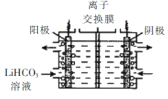
(5)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO31溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是____,该池使用了_________(填“阳”或“阴”)离子交换膜。
Ⅲ.制备 LiFePO4
(6)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是_________。
【答案】研磨、70℃加热 Ni(OH)2、Mg(OH)2、Ca(OH)2 趁热过滤 185ab 4OH--4e-=2H2O+O2↑ 阳 ![]()
【解析】
根据流程可知,将含锂废渣研磨后,在70℃条件下用稀硫酸酸浸其中的金属,得到含有的Li+、Ni2+、Ca2+、Mg2+酸性溶液,其中部分Ca2+与硫酸根离子生成CaSO4沉淀,过滤,滤渣1主要是CaSO4,向滤液1中加入NaOH调节pH=12沉淀Ni2+、Ca2+、Mg2+,滤渣2主要为Ni(OH)2、Mg(OH)2还有极少量的Ca(OH)2,滤液2含有Li+,向滤液2中先加入EDTA,再加入饱和Na2CO3溶液,90℃充分反应后,得到沉淀,趁热过滤得到粗品Li2CO3,将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO3溶液制备高纯度的LiOH,再转化得电池级Li2CO3.将电池级Li2CO3和C、FePO4高温下反应:Li2CO3+2C+2FePO4=2LiFePO4+3CO↑,据此分析作答。
:(1)流程中为加快化学反应速率而采取的措施有研磨、70℃加热;故答案为:研磨、70℃加热;
(2)根据分析滤液1中加入NaOH调节pH=12沉淀Ni2+、Ca2+、Mg2+,故滤渣2主要为Ni(OH)2、Mg(OH)2还有极少量的Ca(OH)2;故答案为:Ni(OH)2、Mg(OH)2、Ca(OH)2;
(3)根据表可知Li2CO3的溶解度小在较高的温度下较小,故90℃充分反应后,通过趁热过滤分离出固体Li2CO3粗品;故答案为:趁热过滤;
(4)lkg含锂3.50%的废渣,锂的浸出率为a,则浸出的n(Li+)=![]() =5amol,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是5amol×0.5×b×74g/mol=185ab g;故答案为:185ab;
=5amol,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是5amol×0.5×b×74g/mol=185ab g;故答案为:185ab;
(5)根据电解图,阳极上发生氧化反应,氢氧根离子放电,电极反应为:4OH--4e-=2H2O+O2↑;阴极上放电的是氢离子,阴极生成OH-,根据题意得到LiOH,则LiOH在阴极生成,Li+移向阴极,故离子交换膜为阳离子交换膜;故答案为:4OH--4e-=2H2O+O2↑;阳;
(6)Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,根据元素分析该气体为CO,则反应为:![]() ;故答案为:
;故答案为:![]() 。
。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】弱酸HA的电离常数![]() 。25℃时,有关弱酸的电离常数如下:
。25℃时,有关弱酸的电离常数如下:
弱酸化学式 | HCOOH | ②CH3COOH | C6H5OH | ④H2A |
电离常数 | 1.810-4 | 1.810-5 | 1.310-10 | K1=4.310-7,K2=5.610-11 |
⑴四种酸的酸性由强到弱的顺序是________________(用序号填空)。
⑵向0.1 mol/L CH3COOH溶液中滴加NaOH至溶液中![]() 时,此时溶液的pH=________。
时,此时溶液的pH=________。
⑶当H2A与NaOH溶液1:1混合溶液显________性(选填“酸、中、碱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯(![]() )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产,环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是
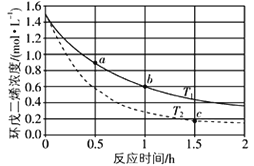
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率小于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同一周期相邻的A、B、C三种元素,都是短周期元素,A的最高价氧化物的化学式是A2O,11.6 g B的氢氧化物恰好能与200 mL 2 mol/L盐酸完全反应,B原子核中质子数与中子数相等。回答以下问题:
(1)B的相对原子质量是多少?原子序数是多少?_____________
(2)A和C各是什么元素?_____________
(3)A、B、C的单质各1 mol分别与足量的稀硫酸反应,产生H2最多的是哪一种单质?该单质产生H2的体积在标准状况下是多少?_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A. △H1>0,△H3<0
B. △H2>0,△H4>0
C. △H1=△H2+△H3
D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素及其化合物叙述中不正确的是( )
A.氧化镁和氧化铝熔点均很高,常用作耐高温材料
B.在酒精灯加热条件下,![]() 和
和![]() 固体都能分解
固体都能分解
C.二氧化氯具有氧化性,可用于自来水杀菌消毒
D.电闪雷鸣的雨天,![]() 与
与![]() 会发生反应并最终转化为硝酸盐被植物吸收
会发生反应并最终转化为硝酸盐被植物吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有V、W、X、Y、Z 五种元素,它们的核电荷数依次增大,且都小于20。其中只有X、Z 是金属元素;V和Z元素原子的最外层都只有一个电子;W和Y元素原子的最外层电子数相同,且W元素原子的L层电子数是K层电子数的3倍;X元素原子的最 外层电子数是Y元素原子最外层电子数的一半。
回答下列问题:
(1)X元素的离子结构示意图为_____________。
(2)Z的最高价氧化物对应水化物的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
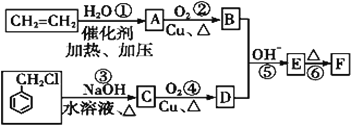
【题目】肉桂醛F (![]() )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的:
已知:两个醛分子在NaOH溶液作用下可以发生反应,生成一种羟基醛:
![]() +
+![]()
![]()
![]()
请回答:
(1)D的名称为___。
(2)反应①~⑥中属于加成反应的是___(填序号)。
(3)写出反应③的化学方程式:____,其反应类型为____。
(4)在实验室里鉴定![]() 分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是___(请按实验步骤操作的先后次序填写序号)。
分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是___(请按实验步骤操作的先后次序填写序号)。
A.滴加AgNO3溶液 B.加NaOH溶液 C.加热 D.用稀硝酸酸化
(5)E的同分异构体有多种,其中之一甲属于酯类。甲可由H(已知H的相对分子量为32)和芳香酸G制得,则甲的结构共有___种。
(6)根据已有知识并结合相关信息,写出以乙烯为原料制备CH3CH=CHCHO的合成路线流程图(无机试剂任选)。______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、M、R均为短周期主族元素,且原子序数依次增大。已知:Y为地壳中含量最多的元素,M原子的最外层电子数与次外层电数之比为3:4;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,请回答下列问题:
(1)M在元素周期表中的位置__;Z+离子的结构示意图为__。
(2)写出X、Y、R按原子个数之比1:1:1形成的化合物的电子式__。
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式__。
(4)实验室制备R的单质,该反应的离子方程式为__。
(5)R非金属性强于M,下列选项中能证明这一事实的是__(填字母序号)。
A.常温下的R单质熔沸点比M单质的高
B.R的氢化物比M的氢化物更稳定
C.一定条件下R和M的单质都能与NaOH溶液反应
D.最高价氧化物对应水化物的酸性强弱:R>M
(6)由X、Y、Z、M四种元素组成的一种弱酸酸式盐A。向A溶液中通入氯气,得到无色溶液,写出该反应的离子方程式__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com