
【题目】下列有关元素及其化合物叙述中不正确的是( )
A.氧化镁和氧化铝熔点均很高,常用作耐高温材料
B.在酒精灯加热条件下,![]() 和
和![]() 固体都能分解
固体都能分解
C.二氧化氯具有氧化性,可用于自来水杀菌消毒
D.电闪雷鸣的雨天,![]() 与
与![]() 会发生反应并最终转化为硝酸盐被植物吸收
会发生反应并最终转化为硝酸盐被植物吸收
科目:高中化学 来源: 题型:
【题目】数十年来,化学工作者对氮的氧化物、碳的氧化物做了广泛深入的研究并取得一些重要成果。
I.已知2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步:2NO(g) ![]() N2O2(g) (快) H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
N2O2(g) (快) H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g) ![]() 2NO2(g) (慢) H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
2NO2(g) (慢) H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
①2NO(g)+O2(g) ![]() 2NO2(g)的反应速率主要是由______(填“第一步”或“第二步”)反应决定。
2NO2(g)的反应速率主要是由______(填“第一步”或“第二步”)反应决定。
②一定温度下,反应2NO(g)+O2(g) ![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;
II.利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放(1)已知重整过程中部分反应的热化方程式为:
① CH4(g)=C(s)+2H2(g) ΔH>0
② CO2(g)+H2(g)=CO(g)+H2O(g) ΔH>0
③ CO(g)+H2(g)=C(s)+H2O(g) ΔH<0
固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。
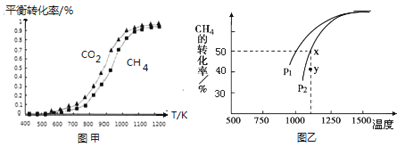
同温度下CO2的平衡转化率________(填“大于”“小于”或“等于”)CH4的平衡转化率。
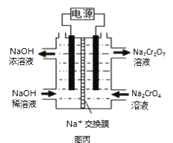
(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g) + CH4(g) ![]() 2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
III.根据2CrO42﹣+2H+ ![]() Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中右侧电极连接电源的__极,电解制备过程的总反应方程式为__。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为a:b,则此时Na2CrO4的转化率为__。若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为__。
Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中右侧电极连接电源的__极,电解制备过程的总反应方程式为__。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为a:b,则此时Na2CrO4的转化率为__。若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,根据三种酸的电离平衡常数,下列判断正确的是![]()
酸 | HX | HY | HZ |
|
|
|
|
A.三种酸的强弱关系: ![]()
B.反应 ![]() 能够发生
能够发生
C.相同温度下,![]() 的NaX、NaY、NaZ溶液,NaZ溶液pH最大
的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,![]() 溶液的电离常数大于
溶液的电离常数大于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学无处不在,下列与化学有关的说法不正确的是( )
A.侯氏制碱法的工艺过程中应用了物质溶解度的差异
B.工业上以氯气和石灰乳为原料制备漂白粉
C.单质硅常用做光导纤维的材料,这与硅的半导体性能有一定关系
D.高压钠灯发出的黄光射程远、透雾能力强,常用做路灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含锂废渣(主要金属元素的含量:Li 3.50% Ni 6.55% Ca 6.41% Mg 13.24%)制备Li2CO3,并用其制备锂电池的正极材料LiFePO4。部分工艺流程如下:
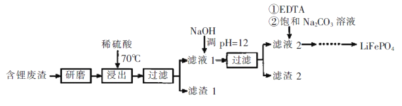
资料:i滤液1、滤液2中部分例子浓度(g·L-1)
Li+ | Ni2+ | Ca2+ | Mg2+ | |
滤液1 | 22.72 | 20.68 | 0.36 | 60.18 |
滤液2 | 21.94 | 7.7×10-3 | 0.08 | 0.78×10-3 |
ii.EDTA能和某些二价金属离子形成稳定的水溶性络合物
iii.某些物质的溶解度(S)
T/℃ | 20 | 40 | 60 | 80 | 100 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
S(Li2SO4)/g | 34.7 | 33.6 | 32.7 | 31.7 | 30.9 |
I.制备Li2CO3粗品
(1)上述流程中为加快化学反应速率而采取的措施是____。
(2)滤渣2的主要成分有____。
(3)向滤液2中先加入EDTA,再加入饱和Na2C03溶液,90℃充分反应后,分离出固体 Li2CO3粗品的操作是_______。
(4)处理lkg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是________g。(摩尔质量:Li2CO3 74 g.mol4)
II.纯化Li2CO3粗品
(5)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO31溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是____,该池使用了_________(填“阳”或“阴”)离子交换膜。
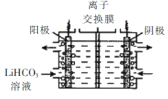
Ⅲ.制备 LiFePO4
(6)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s) ![]() bZ(g) △H<0。图是容器中X、Z的物质的量浓度随时间变化的曲线。根据以上信息,下列说法正确的是
bZ(g) △H<0。图是容器中X、Z的物质的量浓度随时间变化的曲线。根据以上信息,下列说法正确的是

A.根据上图可求得方程式中a∶b=1:3
B.推测在第7min时曲线变化的原因可能是加压
C.推测在第13min时曲线变化的原因可能是升温
D.用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液。试回答下列问题:
(1)甲溶液的pH=________。
(2)乙溶液中由水电离出的H+浓度为________mol·L-1。
(3)常温下,用水稀释0.1 mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是________(填序号)。
①n(H+) ②c(H+) ③![]() ④c(OH-)
④c(OH-)
(4)某同学用甲溶液做标准溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示的两条滴定曲线,请回答有关问题:
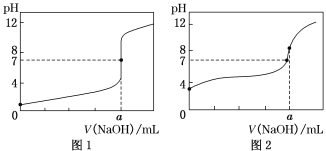
①甲溶液滴定丙溶液的曲线是_______(填“图1”或“图2”)曲线。
②用甲溶液滴定乙溶液实验中,指示剂应选用________,滴定达到终点的现象为:____________,滴定前未用标准液润洗滴定管,则会造成滴定结果______ (填偏高、偏低或无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式错误的是( )
A.Na+的电子排布图:![]()
B.Na+的结构示意图:![]()
C.Na的电子排布式:1s22s22p63s1
D.Na的简化电子排布式:[Ne]3s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生存和发展的重要支柱。研究和有效地开发新能源有重要意义。已知 CH3CH2CH2CH3(g)与 CH3CH(CH3)CH3(g)的燃烧过程如图所示:
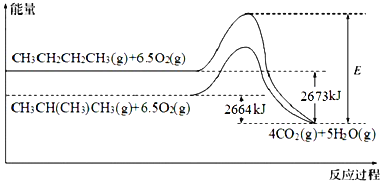
已知:H2O(g)=H2O(l) ΔH=-41kJ·mol-1。请根据以上信息,回答下列有关问题:
(1)图形中 E 表示 CH3CH2CH2CH3(g)燃烧反应逆反应的_____。
(2)CH3CH2CH2CH3(g)与 CH3CH(CH3)CH3(g)的热稳定性_____更高。
(3)表示CH3CH(CH3)CH3(g)燃烧热的热化学方程式为_____。
(4)CH3CH2CH2CH3(g)转化为 CH3CH(CH3)CH3(g)的热化学反应方程式为_____
(5)如表所示是部分化学键的键能参数(已知CO的结构式为C≡O):
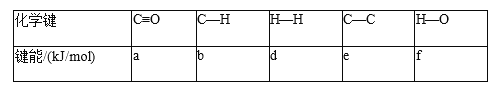
合成气(CO 和 H2 的混合气体)可以合成 CH3CH2CH2CH3(g),同时生成 H2O(g),则合成 1molCH3CH2CH2CH3(g)的 ΔH=__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com